Хотя проблема ВИЧ при аллогенной трансплантации кости является самой серьёзной, не должны оставаться без внимания и другие вирусные и бактериальные возбудители.
Бактериальное загрязнение костных трансплантатов, «стерильно» отобранных в операционных залах, составляет от 15 до 58 процентов (7, 32), причём в основном находят применение головки бедренной кости при операциях полного эндопротезирования. Такой широкий разброс объясняется различными методами обнаружения, причём часто используемый «мазок» ватным тампоном с поверхности трансплантата, конечно, не обеспечивает точного микробиологического диагноза (42).
В то время как в американских и в германских директивах (таблица 3) не требуется серологического исследования донора на предмет вирусных возбудителей, кроме гепатита и ВИЧ, не следует забывать по крайней мере о цитомегаловирусе, энтеровирусе, а также возбудителе Якоба-Крейцфельдта, патогенность которых возможно предполагать в криоконсервированных трансплантатах кости (6).
|
1. Анамнез
- Непринадлежность к группам риска по ВИЧ (наркомания, гомосексуальность, проституция, гемофилия), а также отсутствие половых контактов с лицами, принадлежащими к группе риска;
- отсутствие операций, переливаний крови и продуктов из неё, отсутствие акупунктуры и татуировки за последние 6 месяцев;
- не было гепатита за последние пять лет, не было посещения стран с повышенным риском инфекции гепатита, отсутствие контактов с больными гепатитом;
- отсутствие инфекций с возбудителями тифа, паратифа, энтерита; отсутствие сифилиса, бруцеллёза, риккетсиоза, активного туберкулёза; отсутствие контактов с инфекционными больными (краснуха, корь, паротит и др.) и отсутствие иммунизации живыми вакцинами в последние 6 недель;
- не было посещений эндемичных по малярии районов;
- отсутствуют онкологические заболевания.
|
|
2. Клиническое обследование
- отсутствует увеличение лимфатических узлов, отсутствуют оппортунистические инфекции, отсутствует лимфома, отсутствует молочница;
- отсутствуют неврологические особенности *1
|
|
3. Лабораторная диагностика
- аланинаминотрансфераза в пределах нормы;
- отсутствует антиген гепатита-B (HBsAg);
- отсутствуют антитела к ВИЧ (ВИЧ-1 и -2);
- отсутствуют антитела к сифилису (TPHA);
- отрицательные тесты на ВИЧ-1 и ВИЧ-2 через 3 месяца;
- совместимость по резус-фактору у женщин детородного возраста;
- определение группы крови у женщин детородного возраста, или перед его наступлением *2
|
|
4. Бактериологические исследования
- отрицательные культуры аэробных и анаэробных бактерий из мазков при отборе трансплантата;
- рекомендуется взятие мазков с трансплантата при его использовании.
|
|
5. Хранение трансплантата
- тройная стерильная упаковка;
- хранение при температурах –30 °C и ниже, не дольше, чем один год.
|
На основании этих серьёзных проблем, главнейшей из которых в широком сознании, в конечном счёте, является инфекция ВИЧ после аллогенной трансплантации кости, следует обсуждать альтернативы и исследовать новые формы трансплантатов.
3. Альтернативы аллогенной трансплантации кости
Несомненно, аутогенная трансплантация кости по своей биологической ценности превосходит все альтернативные методы для заполнения дефектов в скелетной системе. Помимо отсутствия риска переноса инфекции, обеспечивается быстрое приживление трансплантата, благодаря пересадке частично витальных остеобластов без развития защитной иммунной реакции. В частности, при инфицированном месте трансплантации, или под угрозой инфекции и с ограничением кровоснабжения, должны применяться только аутогенные трансплантаты.
Однако возможности их применения ограничены в местах обширных дефектов, множественных дефектов или там, где требуется блочный трансплантат, из-за малого количества, а также необходимости двойной операции. Это означает повышенную частоту осложнений, достигающую 20 процентов (12), с послеоперационной инфекцией, нарушением чувствительности и довольно часто, сильными болевыми ощущениями в месте отбора.
При обширных пост-травматических, пост-инфекционных или врождённых зонах дефекта длинных и коротких трубчатых костей предлагается остеогенез через растяжение каллуса по Илизарову как подходящая альтернатива аллогенной трансплантации кости (15, 16). Показания к этому методу ограничены локализацией дефекта, к примеру, в непосредственной близости от сустава, а также его приемлемостью со стороны пациента. При большой длине растяжения необходимо носить аппарат внешней фиксации в течение нескольких месяцев, вследствие чего часто происходят локальные инфекции (9).
Ценность веществ из синтетического или ксеногенного материала для замены кости в настоящее время ещё оспаривается. Часто применяемые раньше килевые костные срезы из мацерированных костей коров должны быть убраны с рынка по причине их неполного освобождения от белка и следующих из-за этого аллергических реакций. Гидроксиапатит во множестве исследований на животных показал достаточную биологическую совместимость (19), однако новая ксеногенная керамика из гидроксиапатита не смогла найти широкого клинического признания. В качестве недостатков этого продукта обнаружилась его слабая возможность подгонки размеров, а также отсутствие резорбции имплантата, которое препятствует постоянному процессу распада и синтеза костей.
Чтобы исключить риск известных вирусных и бактериальных инфекций при аллогенной трансплантации кости, исследованы и клинически испытаны многочисленные методы стерилизации и дезинфекции (таблица 4). Главным образом, для этого используют термические и химические методы, а также обработку ионизирующим излучением. Цель этих процессов – стерилизация кости с максимальным сохранением её биомеханических и биологических качеств.
Таблица 4. Методы стерилизации и дезинфекции аллогенных трансплантатов кости
|
Метод воздействия |
Процесс |
Биологическая безопасность |
Проникновение |
Токсичность |
Канцерогенность, мутагенность |
Биомеханическая пригодность |
Показатели интеграции |
Стоимость |
|
Ионизирующая радиация |
Бета-излучение |
Зависит от дозы |
В блоках ослабляется |
Отсутствует |
Под вопросом |
< 2,5 Мрад хорошая |
< 2,5 Мрад хорошая |
Существенная |
|
Гамма-излучение |
Надежное |
|
Химическая обработка |
Окись этилена |
Доказана |
Надежное |
Да |
Да |
Не влияет |
От удовлетворительной до хорошей |
Существенная |
|
Формальдегид |
Бактерицидное действие зависит от проникновения |
Ненадёжная в крупных блоках кости |
Да |
Да |
|
Бензалкония хлорид |
Нет |
Нет |
|
Бета-пропиолактон |
Да |
Да |
|
Спирт |
Нет |
Нет |
|
Мертиолат |
Да |
Да |
|
Надуксусная кислота |
Да |
Нет |
|
Температурная обработка |
Автоклавирование |
Надежная стерилизация |
Хорошее |
Отсутствует |
Отсутствует |
Существенно ослаблена |
Плохая |
Малая, доступная для локальных костных банков |
|
100 °C |
Надежная дезинфекция |
|
80 °C |
Хорошая |
Хорошая |
|
60 °C |
Ненадежная |
Стерилизация ионизирующим излучением
Источниками излучения, которое применяют для стерилизации, служат ускорители электронов (бета-излучение) и источники с Co-60 (гамма-излучение). Чтобы получить достаточный бактерицидный и вироцидный эффект, требуются дозы облучения не меньше чем 2,5 Мрад (23, 44). При такой мощности дозы во многих исследованиях, однако, наблюдали снижение биологического качества из-за разрушения «морфологических белков кости», а также явное уменьшение биомеханической прочности (23, 27). Кроме того, обсуждается образование при облучении свободных радикалов с возможностью мутагенных свойств (27). Тем не менее, лучевая стерилизация нашла практическое применение в США для обработки аллогенных трансплантатов кости. Ограничивающим фактором стали требуемые дозы облучения. Их возможно достичь только в крупных промышленных установках. Вместе с тем требуется перевозка трансплантата с поддержанием непрерывного охлаждения, что представляет сложную логистическую задачу.
Химическая стерилизация и дезинфекция
Для дезинфекции и стерилизации аллогенных трансплантатов кости были испытаны многочисленные химические вещества. Не считая окиси этилена, которая может проникать даже через массивный корковый слой, все остальные вещества показывают недостаточное проникновение лишь на несколько миллиметров внутрь кости, так что необходима агрессивная предварительная обработка кости путём механической, химической очистки или обезжиривания (24, 30, 35). Помимо частично неполного бактерицидного действия (спирт) многие реагенты оказывают побочное действие: токсичное (формальдегид, окись этилена, надуксусная кислота), возможно канцерогенное и мутагенное (формальдегид, окись этилена, бета-пропиолактон), так что их применение для обработки биологических трансплантатов весьма сомнительно, а отчасти запрещено Федеральным министерством здравоохранения (4).
Термическая стерилизация и дезинфекция
Стерилизующее действие нагрева основано на коагуляции белков и разрушении нуклеиновых кислот. Применение термических процессов для дезинфекции или стерилизации аллогенных трансплантатов кости изучали во множестве экспериментов на животных, в биомеханических и клинических исследованиях (8, 10, 13, 22, 25, 43).
После автоклавирования, т.е. стерилизации при температуре 134 °C и высоком давлении пара, трансплантаты кости показывают сильное (до 85 процентов) снижение биомеханической прочности, а также почти полную потерю биологической ценности (22).
В клиническом использовании проявляется заметная слабость автоклавированных трансплантатов по сравнению с необработанными аллогенными трансплантатами. Наилучших результатов удалось достичь дезинфекцией при температуре 80 °C (25).
4. Статистика случаев и управление костными банками
В клинике хирургической травматологии Марбургского Университета с 1985 по 1992 гг. провели всего 734 операции с аллогенными криоконсервированными трансплантатами кости. Из них 176 были блочными трансплантатами кости. Основные показания заключались в заполнении дефектов при переломах диа- и метафизов нижних конечностей (48 процентов), дорсальных и вентральных спондилодезах (16 процентов), а также лечения пост-травматических дефектов верхних конечностей (15 процентов). В нашем управлении костным банком до 1990 г. применялись «Директивы по управлению банками мышечных и костных тканей», выпущенные Американской ассоциацией банков тканей. Криоконсервацию выполняли при –80 °C, максимальный срок хранения составлял двенадцать месяцев. После опубликования германских Директив, в значительной мере повторяющих американские, стали пользоваться первыми. Притом оказалось, что проведение требуемого второго тестирования на ВИЧ вызывало большие затруднения. В особенности это касалось пожилых и живущих в отдалении пациентов.
Несмотря на «стерильный» отбор при операции, 14 процентов трансплантатов были забракованы из-за бактериального заражения; случаев инфекции ВИЧ у доноров не было; дважды были обнаружены новые заболевания гепатитом.
Вследствие с трудом разрешимых логистических проблем второго тестирования на ВИЧ через три месяца, и ожидаемого при этом остаточного риска, с 1990 г. мы всё чаще применяли автоклавированные трансплантаты. Несмотря на ограниченные показания, особенно в отношении кровоснабжения ложа трансплантата, частота осложнений составляла 21 процент. Это расценили как неприемлемо большую долю, и автоклавированные трансплантаты с тех пор больше не пересаживали.
После оценки экспериментальных данных по дезинфекции нагревом трансплантатов губчатой кости до температуры 80 °C стали всё чаще применять такие трансплантаты. За это время из 87 трансплантатов проявили осложнения 3,5 процента, что примерно соответствует обычным результатам для криоконсервированных трансплантатов.
5. Перспективы
В современной хирургической травматологии и ортопедии дефекты костей, как в неотложной травматологии, так и в реконструктивных операциях и эндопротезировании, представляют весомую проблему. В США, по данным ассоциации тканевых банков, за год проводят свыше 140 000 трансплантаций кости (41).
В ФРГ, без вновь присоединённых регионов и со включением ортопедических клиник, следует считать годовую потребность не меньше 15 000 трансплантатов (18, 21).
Применение исключительно аутогенных трансплантатов как альтернативы аллогенным костям означает тяжёлую нагрузку на пациентов и повышение расходов вследствие расширения оперативного вмешательства.
Вещества-заменители кости, по крайней мере, в достигнутом на сегодня качестве, не в состоянии так же совершенно интегрироваться в место трансплантации, как это клинически и экспериментально показано для аутогенных трансплантатов. Кроме того, в продаже доступны только малые и при этом дорогие блоки.
В таких обстоятельствах ясно, что нужно изыскать возможности дезинфекции или стерилизации трансплантата. Притом требуется, чтобы:
(1) метод был не токсичным и не мутагенным,
(2) гарантировал надёжную дезактивацию возбудителей в трансплантате,
(3) не вызывал значительного снижения биологической ценности в отношении необходимых показателей интеграции.
Как единственный современный метод, который удовлетворяет этим требованиям, рассматривается температурная дезинфекция при 80 °C:
Во-первых, Любые термические методы имеют то преимущество, что не оказывают токсического и мутагенного действия и точно регулируются.
Во-вторых, Гарантируется, что ВИЧ дезактивируется при температуре от 60 до 65 °C и времени обработки 10 мин. (14, 39, 40, 46). То же самое действительно и для других вирусов без оболочки, в частности, для цитомегаловируса и энтеровирусов (14, 29). Поскольку при стерильном отборе трансплантата в операционном зале в качестве возбудителей заражения встречаются только вегетативные бактерии, дезинфекция температурой 80 °C совершенно достаточна, т.к. эта температура с полной уверенностью убивает их (38).
Только возбудитель гепатита В не дезактивируется при 80 °C, и поэтому его проверку необходимо включать в серологическое исследование донора (28).
Вследствие пока ещё неизвестных свойств возбудителя лихорадки Якоба-Крейцфельдта, пациентов с неврологическими особенностями также следует исключать из числа доноров кости (6).
В-третьих, В исследованиях на животных мы смогли доказать, что трансплантаты кости, дезинфицированные при 80 °C, имеют определённо и значительно лучшие показатели интеграции, чем обработанные при 100 °C или автоклавированные препараты. Притом дезинфицированные кости показывают приблизительно равную биологическую ценность с необработанной контрольной группой (25). Это согласуется и с клиническими результатами. Частота осложнений с автоклавированными костями, к тому же, на 16 процентов выше, чем с дезинфицированными при 80 °C трансплантатами (22).
Такие результаты, вероятно, следуют из значительного ослабления биомеханических свойств автоклавированных препаратов, а также полной денатурации остеоиндуктивных белков.
На основании этих результатов мы перевели нашу систему костного банка полностью на термически дезинфицированные трансплантаты. Дезинфекция проводится с помощью специально разработанной системы (Лобатор sd-1). В каждой клинике с локальным костным банком возможно применение этой системы. Полученные до сих пор клинические результаты подтверждают экспериментально установленные данные.
Частота осложнений и наблюдаемые до сих пор показатели интеграции соответствуют аллогенным трансплантатам с обычным криоконсервированием.
Напротив, таким образом исключается инфекция ВИЧ и бактериями через трансплантат (если не считать споры бактерий, наличия которых не ожидается при стерильном отборе в операционном зале [32]). Вирусы без оболочки и возбудитель сифилиса также дезактивируются.
Дополнительное преимущество заключается, кроме того, в устранении антигенности, в особенности по системам ABO и резус-фактора, что тоже было показано на необработанном криоконсервированном трансплантате (20).
Литература:
1. American Association of Tissue Banks: Guidelines for the Banking of Musculo-skeletal Tissues. Am Assoc Tissue Banks Newslett (1979) [Американская ассоциация костных банков: Директивы по банкам мышечных и скелетных тканей].
2. American Association of Tissue Banks: Guidelines for the Banking of Musculo-skeletal Tissues. Am Assoc Tissue Banks Newslett (1991) [Американская ассоциация костных банков: Директивы по банкам мышечных и скелетных тканей].
3. Böhler, J.: Die Knochenbank des Wiener Unfallkrankenhauses. Wien klin. Wochenschr. 62 (1950) 390–391 [Костный банк Венской травматологической больницы].
4. Bundesgesundheitsamt (BGA): Empfehlungen des Bundesgesundheitsamtes zur Frage der Verwendung von Ethylenoxid. BGBL. 29 Nr. 1, 21–22 (1986) [Рекомендации Федерального министерства здравоохранения по вопросу применения окиси этилена].
5. Bush, L. F., C. Z. Garber: The bone bank. JAMA, (1948) 588–594 [Костный банк].
6. CDC: Rapidly progressive dementia in a patient who received a cadaveric dura mater graft. JAMA 257 (8) (1987) 1036–1037 [Клинический случай: Быстро прогрессирующее слабоумие у пациента, которому пересадили трупный имплантат твёрдой оболочки].
7. De Vries, P. H., CE Badgley, JT Hartmann: Radiation sterilization of homogenous bone transplants utilizing radioactive cobalt. A preliminary report. J Bone Jt Surg A 40 (1958) 187–203 [Радиационная стерилизация гомогенных костных трансплантатов с помощью радиоактивного кобальта].
8. Ewers, R., Wangerin, K.: The autoclaved autogenous reimplant, an immediately replaced, mineral frame. J max fac Surg 14 (1986) 138–142 [Автоклавированный аутогенный реимплант, немедленно замещённый минеральный каркас].
9. Franke, J., Simon, M., Hein, G.: Ilizarov-Technik zur Beinverlängerung – Probleme und Ergebnisse. Orthopäde 21 (1992) 197–209 [Метод Илизарова для удлинения бедра – проблемы и результаты].
10. Gallie, WE: The use of boiled bone in operative surgery. Amer Orthop Surg 16 (1918) 373 [Использование кипячёной кости в оперативной хирургии].
11. Gollwitzer, M.: Homologe Spongiosatransplantation. Akt Traumatol 16 (1986) 153–157 [Гомологичная трансплантация губчатой кости].
12. Grob, D.: Autologous Bone Grafts: Problems at the donator site. In: Aebi M., Regazzoni P. (eds.): Bone Transplantation. Springer, Berlin, Heidelberg, New York (1989) 245 [Аутологичные трансплантаты кости: проблемы на донорском месте].
13. Harrington, K. D., Johnston, J. C., Kaufer, H., Luck, J. V., Moore, T. M.: Limb salvage and prosthetic joint reconstruction for low-grade and selected high-grade sarcomas of bone after wide resection and replacement by autoclaved autogenic grafts. Gen Orthopaedics 211 (1986) 180–214 [Реконструкция с сохранением конечности и протезом сустава при саркомах кости лёгкой степени и в отдельных тяжёлых случаях после широкой резекции и замещения автоклавированной аутогенной костью].
14. Horowitz, B.: Specific inactivation of viruses which can potentially contaminate blood products. Develop. biol. Standard 75 (1991) 43–52 [Специфическая дезактивация вирусов, которыми могут быть заражены продукты из крови].
15. Ilizarov, G. A.: The tension-stress effect on the genesis and growth of tissue: Part I. Influence of stability of fixation and soft-tissue preservation. Clin Orthop 283 (1989) 249 [Воздействие растягивающего усилия на генезис и рост тканей: Часть I. Влияние стабильности фиксации и сохранения мягкой ткани].
16. Ilizarov, G. A.: The tension-stress effect on the genesis and growth of tissue: Part II. The influence of the rate and frequency of distraction. Clin Orthop 239 (1989) 263 [Воздействие растягивающего усилия на генезис и рост тканей: Часть II. Влияние силы и частоты натяжения].
17. Inclan, A.: The use of preserved bone graft in orthopaedic surgery. J Bone Jt Surg A 24 (1942) 81 [Использование сохранённого костного трансплантата в ортопедической хирургии].
18. Jerosch, J., Castro, W. H. M., Granrath, M., Rosin, H.: Knochenbanken in der BRD. Ergebnisse einer Befragung. Unfallchirurg 93 (1990) 334–338 [Костные банки в ФРГ. Результаты опроса].
19. Katthagen, B. D.: Knochenregeneration mit Knochenersatzmaterialien. Hefte zur Unfallheilk. 178 (1986) 1–166 [Регенерация кости и материалы для замещения кости].
20. Knaepler, H., Ascherl, R., Kretschmer, V.: Immunisierung gegen Blutgruppenantigene durch allogene Knochentransplantation. Der Chirurg 61 (1990) 830–832 [Иммунизация против групповых антигенов крови при аллогенной трансплантации кости].
21. Knaepler, H., Laubach, S., Götzen, L.: Die Knochenbank – ein standardisiertes Verfahren? Chirurg 61 (1990) 833–836 [Костный банк – стандартный процесс?].
22. Knaepler, H., v. Garrel, T., Seipp, H. M., Ascherl, R., Götzen, L.: Autoklavierung von allogenen Knochentransplantaten als Alternative zur konventionellen Knochenbank? Orthop. Praxis 1 (1991) 18–22 [Автоклавирование аллогенных трансплантатов как альтернатива обычному костному банку?].
23. Knaepler, H., Haas, H., Püschel, H. U.: Biomechanische Eigenschaften thermisch und radioaktiv behandelter Spongiosa. Unfallchirurg 17 (1991) 194–199 [Биомеханические свойства губчатой кости, обработанной температурой и радиацией].
24. Knaepler, H., Koch, F., Bugany, H.: Untersuchungen zur HIV-Inaktivierung in allogenen Knochentransplantaten durch chemische Desinfektion und radioaktive Bestrahlung. Unfallchirurg 18 (1992) 1–6 [Исследования дезактивации ВИЧ в аллогенных трансплантатах кости с помощью химической дезинфекции и радиоактивного облучения].
25. Knaepler, H., v. Garrel, T., Seipp, H. M., Ascherl, R.: Experimentelle Untersuchungen zur thermischen Desinfektion und Sterilisation ällogener Knochentransplantate und deren Auswirkungen auf die biologische Wertigkeit. Unfallchirurg 95 (1992) 477–484 [Экспериментальные исследования термической дезинфекции и стерилизации аллогенных трансплантатов кости и последующего сохранения биологической пригодности].
26. Knaepler, H., v. Garrel, T., Ascherl, R., Götzen, L.: Die 80-°C-Thermoinkubation zur Desinfektion ällogener Knochentransplantate. Hefte zur Unfallheilk. Sonderband zur 56. Jahrestagung der DGU, Berlin 1992 [Термоинкубация при 80°C для дезинфекции аллогенных трансплантатов кости].
27. Körnender, J., Körnender, A., Dziedzic-Goclawska, A., Ostrowski, K: Radiation-sterilized bone grafts evaluated by electron spin resonance technique and mechanical tests. Transplant Proc 89 (1976) 25–37 [Исследования стерилизованных радиацией трансплантатов кости методом электронного парамагнитного резонанса и механическими испытаниями].
28. Krugmann, S., Giles, J. P.; Hammond, J.: Hepatitis virus: effect of heat on the infectivity and antigenicity of the MS I and MS II strains. J Infec Dis 122.5 (1970) 422–436 [Вирус гепатита: влияние нагрева на инфекционность и антигенность штаммов MS I и MS II].
29. Lehe, P. N., Reesink, H. W., Lucas, C. J.: Inactivation of 12 viruses by heating steps applied during manufacture of a hepatitis B Vaccine, J Med Virology 23 (1987) 297–301 [Дезактивация 12 вирусов ступенчатым нагреванием, применяемым при изготовлении вакцины против гепатита В].
30. Lo Grippo, G. A., Burgess, B., Teodoro, R., Fleming, J. L.: Procedure for bone sterilization with beta-propriolactone. J Bone JT Surg A 39 (1957) 1356–1364 [Процедура стерилизации кости бета-пропиолактоном].
31. Macewen, W.: Observations concerning transplantation on bone. Proc R Soc Lond 32 (1881) 232 [Наблюдения относительно трансплантации кости].
32. Malinin, T. I., Martinez, O. V., Brown, M. D.: Banking of massive osteoarticular and intercalary bone allografts - 12 years experience. Clin Orthop Rel Res 197 (1985) 44–57 [Банк массивных костно-артикулярных и интеркалярных аллогенных трансплантатов кости – 12 лет опыта].
33. Martin, L. S., McDougal, J. S., Loskoski, S. L.: Disinfection and inactivation of the human T lymphotropic virus type III / lymphadenopathy-associated virus. J Infect Dis 152 (1985) 400–403 [Дезинфекция и дезактивация Т-лимфотропного вируса типа III человека / вируса, связанного с аденопатией].
34. Munting, E., Wilmart, J. F., Wijne, A., Hennebert, P., Delloye, C: Effect of sterilization on osteoinduction. Acta Orthop Scand 59 (1988) 34–38 [Влияние стерилизации на остеоиндукцию].
35. Prolo, D. J., Oklund, S. A.: Sterilization of bone by chemicals. In: Osteochondral Allografts. Eds. Friedlaender G. E., Mankin, H. J., Seil, K. W., Little & Brown Boston, Toronto (1987) [Стерилизация кости химикатами].
36. Ranki, A., Valle, S. L., Krohn, M., Antonen, J., Allain, J.-P., Leuther, M., Franchini, G., Krohn, K.: Long latency precedes overt seroconversion in sexually transmitted human-immunodeficiency-virus infection. Lancet 2 (1987) 589–593 [Долгий латентный период предшествует открытой сероконверсии в передаваемой половым путём инфекции вируса иммунодефицита человека].
37. Regel, G., Südkamp, N. P., Illgner, A., Buchenau, A., Tscherne, H.: 15 Jahre allogene Knochentransplantation. Unfallchirurgie 95 (1992) 1–8 [15 лет аллогенной трансплантации кости].
38. Sneath, P. H. A.: Endospore-forming gram-positive rods and cocci. In: Bergey's Manual of Systematic Bacteriology. Williams & Wilkins, Baltimore, 2nd. Vol. (1986) [Грам-положительные палочки и кокки, образующие эндоспоры].
39. Spire, B., Dormont, D., Barre-Sinoussi, F., Montagnier, L., Chermann, J. C: Inactivation of lymphadenopathy-associated virus by heat, gamma rays, and ultraviolet light. Lancet II (1985) 188–190 [Дезактивация вируса, связанного с лимфоаденопатией, с помощью нагрева, гамма-лучей и ультрафиолетового света].
40. Tjotta, E., Hungnes, O., Grinde, Björn: Survival of HIV-1 activity after disinfection, temperature and pH changes, or drying. J Med Virology 35 (1991) 223–227 [Выживание активности ВИЧ-1 после дезинфекции, нагревания, изменений рН и высушивания].
41. Tomford, W., Fortini, B.: Musculo-skeletal Allografts in 1990–1992: A Survey of US Tissue Banks. AATB, 16th Annual Meeting, San Diego (1992) [Мышечно-скелетные аллогенные трансплантаты в 1990–1992 гг.: Обследование тканевых банков в США].
42. v. Garrel, T., Knaepler, H., Mutters, R.: Quality of microbiological testing methods for evalution of bacterial contamination on allogenic bone grafts. AATB, 16th Annual Meeting, San Diego (1992) [Качество методов микробиологического тестирования для оценки бактериального заражения аллогенных костных трансплантатов].
43. Wagner, M., Pesch, H. J.: Autoklavierte Knochenspäne beim Prothesenwechsel an der Hüfte. Orthopäde 18 (1989) 463–467 [Автоклавирование костных срезов при замене протеза в тазобедренном суставе].
44. Wallhäuser, G.: Praxis der Sterilisation-Desinfektion-Konservierung. Georg Thieme-Verlag, Stuttgart (1987) [Практика стерилизации, дезинфекции и консервирования].
45. Wissenschaftlicher Beirat der Bundesärztekammer, Richtlinien zum Führen einer Knochenbank. Dt. Ärzteblatt 87 (1990) 41–45 [Директивы по управлению костными банками].
46. Zeichhardt, H., Scheiermann, N., Spicher, G., Deinhardt, F.: Stabilität und Inaktivierung des HIV. Bundesgesundhbl. 30 (1987) 172–177 [Стабильность и дезактивация ВИЧ].
Адрес авторов:
PD Dr. med. Harald Knaepler
Unfallchirurgische Klinik
Kreiskrankenhaus Wetzlar
Postfach 19 49 35573 Wetzlar
Федеративная Республика Германия
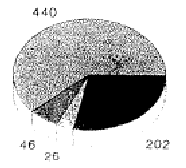
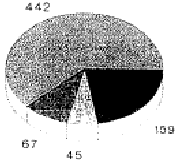

 Ксеногенные
Ксеногенные Аллогенные
Аллогенные