Остеосинтез международный
Остеосинтез международный [Прилож. 1] (2000) 8: с. 231 – с. 234
© Johann Ambrosius Barth 2000
О применении аллогенных трансплантатов кости в хирургии позвоночника
Показания, методы и результаты
А. Юнге, Т. фон Гаррель, И. Целик, М. Шедель-Хопфнер, Л. Гётцен
Клиника травматологической хирургии
(Директор: проф. д-р Л. Гётцен)
Университет Филиппа, Марбург
Д-р Андреас Юнге
Клиника травматологической хирургии
Университет Филиппа, Марбург
Адрес: Baldingerstraße
D-35033 Marburg – Германия
Тел.: +49-6421/2866216
Факс: +49-6421/2 866721
e-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.
При применении трансплантатов губчатой кости в хирургии позвоночника следует принимать во внимание две особенности. Во-первых, часто приходится перекрывать крупные дефекты и, во-вторых, применяемые трансплантаты часто должны принимать на себя функцию стабилизации.
Конечно, идеальный трансплантат – это аутогенный трансплантат. В отношении биологической совместимости и приживления он обладает отличными свойствами. Кроме того, через аутогенный трансплантат губчатой кости исключается передача инфекций. Проблемы при применении аутогенных трансплантатов представляют только их ограниченная доступность и некоторая болезненность на месте отбора ткани. Отдельные исследования [2, 3] сообщают о проблемах на месте отбора в 30–40% случаев.
Преимуществами аллогенных трансплантатов губчатой кости является их доступность и, конечно, отсутствие болезненности для донора. Недостатки заключаются в риске, по крайней мере теоретическом, переноса инфекционных микроорганизмов и, конечно, в сниженной биологической активности по сравнению с аутогенным материалом и с последствиями трудного процесса приживления. Экспериментальные исследования показали снижение на 15–20 % стабильности аллогенных трансплантатов губчатой кости по сравнению с аутогенными трансплантатами [6].
В клинике травматологической хирургии Университета Филиппа в Марбурге применяют как аутогенные, так и аллогенные трансплантаты. На основании анализа клинических данных с 1986 по 1998 годы мы представим показания к аутогенной и аллогенной пластике губчатой костью в позвоночнике, а также методы и полученные результаты операций. Кроме того, мы особо покажем осложнения в этом процессе. Притом мы ограничимся слияниями в грудном и поясничном отделах позвоночника, поскольку применение аллогенных трансплантатов губчатой кости на шейном отделе имеет исключительные показания.
Пациенты и методы
В клинике травматологической хирургии Университета Филиппа в Марбурге с 1986 по 1998 годы было проведено 290 операций инструментирования, включающих пластику губчатой костью, при травматической неустойчивости и пост-травматических смещениях в грудном и поясничном отделах позвоночника. Локализация повреждений распространялась на весь грудной отдел и весь поясничный отдел позвоночника, с ожидаемым сосредоточением в торако-люмбальном переходе (рис. 1). Чаще всего оказывалось затронутым тело первого поясничного позвонка.
Для вентральной стабилизации травмы или смещения грудных и поясничных позвонков мы применяли аллогенные трансплантаты как блочные трансплантаты для заполнения дефектов с одновременной стабилизирующей функцией. В дорсальном слиянии при нестабильности торако-люмбальных позвонков мы применяли аллогенные трансплантаты в виде межостистой Н- пластины на винтах, а также межпластинных прослоек губчатых срезов, чтобы достичь надёжного слияния в области заднего столба.
Раздельно по видам, за годы с 1986 по 1998, были выполнены вентральные операции инструментирования и слияния у 50 пациентов, дорсальные операции у 202 пациентов. Сочетания дорсо-вентрального слияния были проведены у 38 пациентов.
Наши вентральные операции выглядели следующим образом: для доступа в грудном отделе позвоночника мы применяли правостороннюю антеролатеральную торакотомию. Для доступа в области торако-люмбального перехода мы выбирали левостороннюю торакофренолюмботомию по Луи, а в области средних и нижних поясничных позвонков мы применяли левостороннюю люмботомию. Обычно мы оперировали в положении пациента лёжа на спине, при необходимости с растяжением и гиперлордозом. Затем выполняли удаление или частичное удаление тела повреждённого позвонка. После этого вырезали блочный трансплантат подходящего размера из аллогенной головки бедренной кости и вставляли его методом подгонки с прижимом (press-fit). При необходимости, в случаях распространённых дефектов, две пригнанных вырезанных головки бедренной кости соединяли винтами. Инструментацию мы выполняли до 1996 г. с одной или двумя DC- пластинами, а с 1997 г. применяли внутренний фиксатор со стабильным углом.
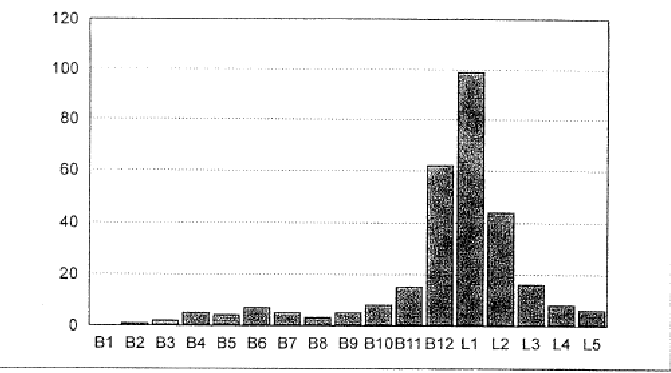
Рис. 1. Локализация 290 переломов грудных и поясничных позвонков, на которых выполняли трансплантацию аллогенной кости.

Рис. 2. Положение в ходе операции после дорсальной инструментации внутренним фиксатором и прижимом аллогенной межостистой H- пластины. После этого была нанесена прослойка измельчённой аллогенной губчатой кости.
Для дорсального спондилодеза на грудных и поясничных позвонках мы применяли типичный дорсальный подход со свободной препарацией дуг, переходя малые позвонковые суставы. Затем по типичным ориентирам мы направляли сверление транспедикулярных отверстий, после чего мы старались добиться того, чтобы инструментация или слияние было как можно короче. С 1993 г. мы всегда проводили транспедикулярную пластику по направлению Данио, и для этого выполняли транспедикулярное сверление второго отверстия с диаметром, составляющим 6 мм. После освобождения места разрушенного межпозвонкового диска, с помощью соответствующих инструментов извлекали аутогенную губчатую кость из заднего гребня подвздошной кости и вставляли её между тел и внутрь тел позвонков [5]. Добавочно мы всегда проводили, но только перед выполнением транспедикулярной пластики губчатой костью, дорсальную пластику губчатой костью аллогенным материалом из костного банка. Для этого сначала вырезали, зачастую удлинённые или разрушенные, межостистые связки, и вставляли между остями на винтах Н- пластину, предварительно вырезанную из аллогенной головки бедренной кости. Затем мы вставляли аллогенные губчатые срезы между пластинами (Рис. 2). Удаление имплантата выполняли, как правило, через 12 – 18 месяцев (Рис. 3).
С 1986 по 1990 годы мы применяли исключительно криоконсервированные аллогенные кости. С началом развития системы Марбургского костного банка [6, 7] в 1991 и 1992 гг. мы устанавливали трансплантаты губчатой кости, обработанные на прототипе [аппарата] Лобатор. С 1993 г. мы применяли исключительно трансплантаты, обработанные на Лобаторе 1, а позже на Лобаторе 2. Из применённых нами, 152 трансплантата были криоконсервированными либо обработанными на прототипе Лобатора, 138 трансплантатов были обработанными на Лобаторе 1 либо Лобаторе 2.

Рис. 3. Положение в ходе операции после удаления имплантата. Хорошо различается прочное костное слияние после межостистой и межпластинной пластики губчатой костью.
Оценку проведённых 290 операций аллогенной пластики губчатой костью в грудном и поясничном отделах позвоночника в отношении процесса приживления, рентгенологического наблюдения и осложнений выполняли на основании базы данных о травмах позвоночника и базы данных костного банка Клиники травматологической хирургии Университета Филиппа в Марбурге.
Результаты
Все 290 пациентов, которые прошли операцию аллогенной трансплантации губчатой костью на позвоночнике, были изучены на основании сведений из названных выше баз данных. Группа содержала 192 мужчины и 98 женщин со средним возрастом 40,8 года. Относительно процессов заживления не установлено различий между предварительно термически обработанными трансплантатами (Лобатор 1 и 2) и не обработанными трансплантатами. Все установленные трансплантаты прочно приживились, причём в частности, вживление вентральных блочных трансплантатов потребовало времени до двух лет. Относительно вторичной потери коррекции мы анализировали две подгруппы.
В группе пациентов с вентральной или комбинированной дорсовентральной стабилизацией и слиянием проводили рентгенологическое наблюдение и оценку 68 пациентов. Здесь проявился один случай изменения положения оси (измеренного как угол между основными пластинами и покровными пластинами) от 4,7° через три месяца после операции до 10,3° в последнюю дату измерения (не менее 12 месяцев после операции). Это соответствует вторичной потере коррекции на 5,6°.
Далее, анализировали группу пациентов с односегментным дорсальным инструментированием и слиянием (n = 47). У всех этих пациентов была выполнена аллогенная пластика между остями и между пластинами. У 26 пациентов была проведена дополнительная транспедикулярная аутогенная пластика губчатой костью по описанному выше методу. У этих пациентов оценивали послеоперационную потерю коррекции как угол кифоза, измеренный по Коббу. В этой группе пациентов проявился один случай послеоперационной потери коррекции на 3,1° на 15-й месяц после операции. Не было выявлено различия между пациентами с дополнительной транспедикулярной пластикой губчатой костью и без неё.
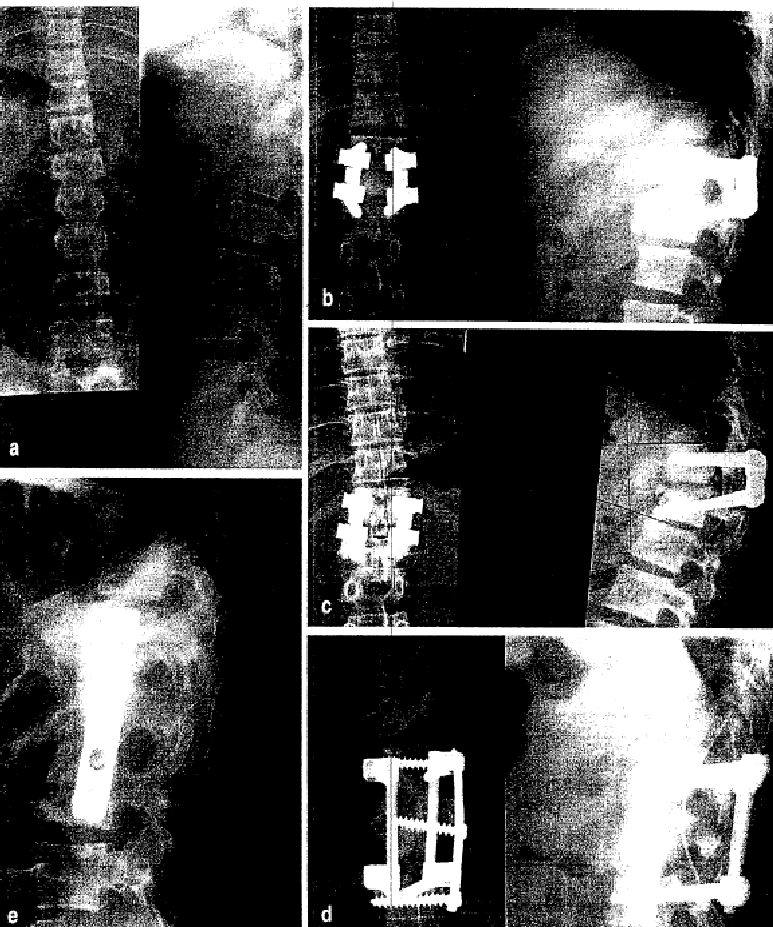
Рис. 4, a. Снимок травмы 16-летней пациентки с трещинным переломом позвонка Т12 после падения из окна;
b. Контрольный снимок после односегментного дорсального спондилодеза с внутренним фиксатором, пластикой губчатой костью – аутогенной транспедикулярной, и аллогенной между остями и между пластинами;
c. Сращение перелома и несостоятельный спондилодез через 9 месяцев после лечения, после того как пациентка возобновила свои спортивные занятия;
d. Удаление имплантата и дорзовентральный коррекционный спондилодез с вентральной вставкой большого аллогенного блочного трансплантата. Теперь снова правильное положение оси;
e. 18 месяцев после коррекционного спондилодеза и последовавшего за ним удаления фиксаторов; не изменённое правильное положение оси при отсутствии клинических жалоб у пациентки. Полностью интегрированный аллогенный костный блок.
Как осложнения, мы выявили в группе с вентральной вставкой костного блока две гематомы, требующие очистки. После очистки гематом произошло беспрепятственное заживление в обоих случаях. Поздние осложнения не наблюдались, в частности, не происходило несостоятельности трансплантата и каких-либо инфекций, которые могли быть связаны с трансплантатом.
В группе пациентов с дорсальным инструментированием и трансплантацией мы выявили всего четыре инфекционных осложнения, которые были всё же лишь поверхностными, и были устранены поверхностной очисткой при оставлении дорсальных трансплантатов губчатой кости до их заживления. Кроме того, у трёх пациентов произошло расшатывание винтов. В одном случае потребовалось оперативное исправление, а в двух других случаях это устранилось уже завершённым слиянием кости, так что провели только лишь удаление металлических частей. Дальнейшие осложнения произошли у двоих пациентов как преходящая корешковая симптоматика, которая со временем полностью отступила.
У одной пациентки с односегментным дорсальным спондилодезом впоследствии развилась несостоятельность имплантата. Это молодая сильная пациентка, которая после падения из окна получила неполный трещинный перелом первого поясничного позвонка. У этой пациентки не удалась попытка односегментного инструментирования и слияния. После возобновления спортивных занятий пациентки (спортивный баскетбол и волейбол) произошло ослабевание фиксаторов и сращение перелома с последующими болями. В этом случае потребовался корректирующий дорсовентральный спондилодез. После освобождения сросшихся позвонков мы вставили блочный трансплантат с вентральной стороны и закрепили его пластиной. Дополнительно провели дорсальную инструментацию и слияние с аллогенным костным материалом по описанному выше методу. После образования спондилодеза жалобы у пациентки прошли и она вернулась к интенсивному спорту (рис. 4). Дорсальные имплантаты впоследствии были удалены.
Таки возможные осложнения, как глубокие инфекции внесённые с трансплантатом, не наблюдались во всей группе 202 пациентов с дорсальной пластикой губчатой костью.
Обсуждение
В хирургии позвоночника необходимо применение трансплантации губчатой кости, чтобы возле инструментации нестабильного сегмента позвоночника достичь также и надёжного слияния кости. Поэтому к трансплантату предъявляются высокие требования. Во-первых, часто бывает нужно перекрывать большие дефекты и, во-вторых, вставляемые трансплантаты часто имеют функцию стабилизации. Поэтому идеальным трансплантатом, конечно, служит аутогенный трансплантат на основании его биологических свойств [4]. Однако применение аутогенных трансплантатов кости в хирургии позвоночника зачастую ограничено. При вентральных спондилодезах после извлечения разрушенного тела позвонка остаётся такой большой дефект, который невозможно возместить аутогенным блочным трансплантатом с одновременным принятием стабилизирующей функции. Доступность аутогенных трансплантатов губчатой кости анатомически ограничена. Кроме того, следует иметь в виду существенную болезненность в месте отбора. Некоторые исследования сообщают о проблемах в месте отбора в 30–40 % случаев [2, 3].
Доступность аллогенных трансплантатов губчатой кости теоретически не ограничена. Не существует проблем в отношении болезненности места отбора. Недостаток аллогенного трансплантата – тяжёлы или долгий процесс приживления по сравнению с аутогенным трансплантатом, поскольку аллогенный трансплантат служит сопровождающей костной структурой и не встраивается сам. В частности, большим вентрально вставленным блочным трансплантатам требуется для присоединения к кости до 24 месяцев. При обеспечении увеличенных периодов времени происходит надёжное приживление.
Проблематичным остаётся, по крайне мере теоретически, риск переноса инфекции. В 1988 г. был отмечен первый случай инфекции ВИЧ с криоконсервированным трансплантатом кости [1]. Со времени внедрения температурной дезинфекции для обработки трансплантатов кости, гарантируется надёжное уничтожение или дезактивация микробного и вирусного заражения. Это было доказано обширными предварительными исследованиями [6, 7] и сейчас уже общепризнано, так что даже согласно «Директивам по управлению костным банком» Федеральной врачебной палаты [8], отменены обязательные повторные тесты трансплантатов на антитела к ВИЧ через 6 месяцев, если применяется дезинфицированные температурой трансплантат.
В заключение мы можем сказать, что аллогенные трансплантаты кости в хирургии позвоночника испытаны, как безопасные и надёжные трансплантаты. Причём аутогенные и аллогенные трансплантаты кости не конкурируют, а дополняют друг друга по различным показаниям. Если аутогенный трансплантат достаточной величины возможно получить без значительной болезненности в месте отбора, то на основе его превосходных биологических свойств ему следует отдать предпочтение. Если же это невозможно, то имеется в распоряжении действенная альтернатива аллогенного трансплантата кости, дезинфицированного температурой.
Литература
1 CDC. Transmission of HIV through bone transplantation: case report and public health recommendation. Münch Med Wochenschr 1988; 37: 597-599 [Передача ВИЧ через трансплантацию кости: история болезни и рекомендации для здравоохранения]
2 Garlipp M. Spongiosaentnahme am Bekkenkamm und Meralgia paraesthetica. Zentralbl Chir 1979; 104: 658-660 [Отбор губчатой кости на крыле подвздошной кости и парестезия Бернгардта]
3 Grob D. Autologous bone grafts: problems at the donator site. In: Aebi M, Regazzoni P (Eds). Bone tranplantation. Springer, Berlin, Heidelberg, New York 1989 [Аутогенные трансплантаты кости: проблемы на донорском месте]
4 Hierholzer G, Zilch H. Transplantatlager und Implantatlager bei verschiedenen Osteosyntheseverfahren. Springer, Berlin, Heidelberg, New York 1980 [Хранение трансплантатов и имплантатов в различных методах остеосинтеза]
5 Junge A, Götzen L, von Garrel T, Ziring E, Giannadakis K. Die monosegmentale Fixateur interne-Instrumentation und Fusion in der Behandlung von Frakturen der thorakolumbalen Wirbelsäule. Unfallchirurg 1997; 100: 880-887 [Внутренняя инструментация и слияние с односегментным фиксатором в лечении переломов грудных и поясничных позвонков]
6 Knaepler H, von Garrel T, Götzen L. Untersuchungen zur Desinfektion und Sterilisation allogener Knochentransplantate. Hefte Unfallheilkd 1994; 235: 1-101 [Исследования по дезинфекции и стерилизации аллогенных трансплантатов кости]
7 von Garrel T, Knaepler H. Surgical femoral head allograft processing System using moderate heat. In: Philipps GO, Strong DN, von Versen R, Nater A (Eds.) Advan-ces in tissue banking: 283-354, World Scientific Verlag, Singapore, New Jersey, London 1999 [Система обработки с использованием умеренного нагрева для аллогенного хирургического трансплантата из головки бедренной кости]
8 Wissenschaftlicher Beirat der Bundesärztekammer. Richtlinien zum Führen einer Knochenbank. Dtsch Ärztebl 1996; 93: 1715-1719 [Директивы по управлению костным банком]
