| Испытания биологической совместимости различных стерилизованных или дезинфицированных аллогенных трансплантатов кости в сравнении с золотым стандартом пересадки аутологичной кости – In vitro анализ иммуномодуляции |
S. Endres1,3
M. Kratz1,3
Μ. Heinz3
C. Herzberger3
S. Reichel3
T. von Carrel1
L. Götzen1
A. Wilke2,3
|
|
Biocompatibility Testing of Different Sterilised or Disinfected Allogenous Bone Crafts in Comparison to the Cold Standard of Autologous Bone Grafts – An in vitro Analysis of Immunomodulation
|
|
Краткое содержание
Введение:
Терапия крупных дефектов кости при помощи пересадки аутологичной кости является самым естественным методом. Однако он ограничен тем, что возможен отбор лишь малого количества костной ткани, который сопровождается явно повышенной болезненностью. В представленной работе исследовано влияние различных стерилизованных или дезинфицированных аллогенных трансплантатов кости на дифференцировку костного мозга человека, и результаты сравниваются с аутогенными трансплантатами.
Методы:
Культивировали клетки костного мозга человека из губчатой кости, которую отбирали в процессе операции по замене тазобедренного сустава из проксимального тела бедренной
кости. Диски губчатой кости человека, диаметром 10 мм и высотой 3 мм, заготавливали из головки бедренной кости, которую удалили в процессе операции по замене тазобедренного сустава, и стерилизовали либо дезинфицировали различными методами (γ-облучение, обработка НУК / этанолом, метод Tutoplast ®, автоклавирование при 121 °C, термодезинфекция при > 82,5 °C). Дополнительно, симулировали in vitro пересадку аутологичной кости и сравнивали результаты с аллогенной пересадкой кости. Endobon ® оценивали так же, как керамику из бычьего гидроксиапатита. В течение периода 4 недель каждый второй день проводили смену среды (IMDM). Выполняли морфологическое исследование растровой электронной микроскопией. Для определения жизнеспособности проводили окрашивание трипановым синим. В начале культивирования, а также через 4 недели проводили анализ FACS со специфичными антителами. Контрольной группой служили культуры клеток костного мозга человека без трансплантата кости.
Результаты:
Через 4 недели на поперечном срезе, 2/3 клеток были жизнеспособны, за исключением облучённых дисков губчатой кости. По сравнению с контрольными культурами, после периода в 4 недели было показано достоверное различие в иммунной реакции, как в опытах с аутологичной пересадкой, так и при различных методах стерилизации либо дезинфекции аллогенных трансплантатов. Морфологический анализ показал трещины на поверхностях трабекул в облучённых и автоклавированных губчатых дисках, и показал проникновение клеток в трабекулярные структуры при всех методах.
Заключение:
Представленные результаты подтверждают влияние различных методов стерилизации и дезинфекции на дифференцировку клеток костного мозга человека (клетки реципиента). Автоклавирование и термодезинфекция при 82,5 °C достигали сходных эффектов in vitro в опытах с аутологичной пересадкой. Обработка аллогенных трансплантатов кости НУК / этанолом, и методом Tutoplast ® показала то же, что и Endobon ® со слабыми отличиями по сравнению с контрольными культурами. Гамма-облучение аллогенного трансплантата кости приводило к чрезмерной смертности клеток, предположительно по причине образования свободных радикалов.
Ключевые слова - Стерилизация · In vitro · Аутологичный · Аллогенный · Костный банк · Биологическая совместимость
Сокращения:
РЭМ – растровая электронная микроскопия, IL – интерлейкин, НУК – надуксусная кислота, GM-CSF – колониестимулирующий фактор гранулоцитов и макрофагов, FACS – сортировка клеток с активацией флуоресценции, PBS – фосфатно-солевой буфер
Основное содержание
Введение:
Аллогенная трансплантация кости – это существенная составная часть в лечении обширных дефектов кости, прежде всего, при операциях протезирования и реконструкции после удаления опухолей кости. В США, ведущей в мире стране по числу пересадок кости, количество использованных аллогенных трансплантатов кости составляет от 650 000 до 800 000 в год [1]. В Германии к настоящему времени проводили около 75 000 аутологичных и 25 000 аллогенных трансплантаций кости в год [2, 3].
Наряду с аллогенными трансплантатами кости, используют аутологичную костную ткань, материалы из бычьей кости и искусственные материалы, а также живые культуры клеток хряща и кости (тканевая инженерия).
Аутологичная пересадка кости представляет самый естественный и эффективный метод лечения дефектов кости и считается золотым стандартом, поскольку остеогенные свойства трансплантатов остаются сохранными. Аутологичная трансплантация кости подразумевает повышенную болезненность ввиду необходимости одновременной операции на гребне подвздошной кости, помимо болевых послеоперационных симптомов [4].
По сравнению с искусственными материалами-заменителями кости, такими как костный цемент, керамика из гидроксиапатита, или же материалом из бычьей кости, важнейшее достоинство аллогенных трансплантатов кости заключается в их способности к остеокондуктивному и, частично, остеоиндуктивному действию.
Трансплантация аутогенной кости неизменно остаётся стандартом в реконструктивной ортопедической хирургии и травматологии. Применение аллогенных трансплантатов кости требует выполнения определённой технологии консервации, методов скрининга доноров и методов стерилизации.
Со времени учреждения костных банков было предложено множество методов стерилизации либо дезинфекции [5]. В настоящее время находят применение различные методы для инактивации бактерий, вирусов и спор грибков. Независимо от того, используется ли для стерилизации трансплантата кости физическая стерилизация путём гамма-облучения [6], химическая обработка НУК / этанолом [7, 8], либо комбинированная обработка, напр. методом Tutoplast® или тепловым методом [9], в каждом методе достигается максимальная инактивация бактерий и вирусов.
Разнообразные влияния различных методов на биомеханические свойства кости были исследованы во множестве работ [10–13].
Однако в текущей литературе имеется лишь немного информации о том, при каком методе происходит наименьшая потеря остеогенных, остеокондуктивных и остеоиндуктивных свойств кости.
В представленной работе было исследовано in vitro влияние гамма-облучения, обработки НУК / этанолом, методом Tutoplast®, автоклавированием при 121 °C и термодезинфекцией при > 82,5 °C, с учётом возможных изменений дифференцировки клеток костного мозга человека, и проведено сравнение с опытом на аутологичном материале. Исследовали Endobon® так же как керамику из бычьего гидроксиапатита. Аллогенные и аутологичные трансплантаты, кроме того, после четырёхнедельного культивирования исследовали методом растровой электронной микроскопии.
Материал и методы:
- Получение материала
Головки бедренных костей и костный мозг для выделения клеток получали в процессе операции эндопротезирования бедренного сустава. Костный мозг отбирали из проксимальной части и головки бедренной кости после остеотомии головки бедренной кости (одобрено Комиссией по этике в области медицины человека, Университет Филиппа, Марбург: AZ 66/03).
Критериями исключения были острое или хроническое воспаление, злокачественные опухоли в анамнезе, а также возраст > 75 лет. Согласно директивам по содержанию костного банка, пациентов исследовали серологически на наличие инфекций ВИЧ, гепатита, сифилиса. Для уменьшения риска привлекали записи анамнеза доноров аллогенных трансплантатов кости.
Помимо коксартроза, который стал причиной операции, все пациенты не имели предшествующих заболеваний. Для достижения статистической значимости, на каждый метод стерилизации и аутологичную пересадку оценивали по 8 пациентов (4 мужчины и 4 женщины в возрасте от 45 до 70 лет).
- Выделение клеток
Блок губчатой кости размером ок. 7 мм × 10 мм × 20 мм, во избежание свёртывания крови и высыхания, помещали в стерильный сосуд с фосфатным буфером, содержащим ликвемин (0,2% Liquemin, изготовитель Hoffmann–La Roche; pH 7,4 PBS, изготовитель Seromed). После механического измельчения полученную суспензию пропускали через сито с размером ячеек 0,1 мм, чтобы отделить фракцию губчатой кости. Эту суспензию клеток наслаивали на градиент плотности Ficoll/Histopaque (в соотношении 2:1; плотность 1,077). После центрифугирования (20 мин., 2 200 об./мин., 10 °C, без торможения, бакет-ротор JS-7.5, изготовитель Beckmann (США), rmax = 142 мм) возможно отделение промежуточной фазы от клеточного осадка.
Образованную промежуточную фазу и осадок клеток извлекали пипеткой, центрифугировали (10 мин., 1900 об./мин., 10 °C, с торможением, бакет-ротор JS-7.5, изготовитель Beckmann (США), rmax = 142 мм) и содержащиеся здесь клетки трижды промывали раствором PBS. В последнем цикле промывки применяли IMDM [14–16].
- Среда
К среде IMDM (среда Дюльбекко в модификации Искове, изготовитель Life Technologies, Paisley, Шотландия) добавляли 12,5% FCS (фетальная телячья сыворотка, изготовитель Boehringer Mannheim, Германия), 12,5% HS (лошадиная сыворотка, изготовитель PAA Linz, Австрия), 2,4 нг/мл гидрокортизона (изготовитель Sigma Diagnostic, St. Louis, США), 50 нг/мл сертомицина (изготовитель Essex Pharma, München, Германия), 292,2 нг/мл L-глутамина (изготовитель PAA Linz, Австрия) и 0,3% NaHCО3 (изготовитель Merck, Darmstadt, Германия). Для стимуляции клеточной культуры вводили факторы роста интерлейкин-3 [IL-3] (Behring AG, Marburg, Германия) и колониестимулирующий фактор гранулоцитов и макрофагов [GM-CSF] (Behring AG, Marburg, Германия) в концентрации 10,0 нг/мл среды при каждой смене среды.
- Обработка материала
Головки бедренных костей, которые удалили в процессе операции полного эндопротезирования бедренного сустава, отбирали после остеотомии головки бедренной кости и в стерильных условиях распиливали по горизонтальной плоскости на диски толщиной 3 мм с помощью алмазной ленточной пилы (Exakt 310). Из каждого диска был приготовлен с помощью специального пустотелого бора (диаметр: 10 мм) цилиндр губчатой кости. В течение всего процесса обработки кости орошали стерильным раствором 0,9% NaCl (4–6 °C), во избежание повреждения вследствие нагрева во время пиления или сверления, а также высыхания. Затем костные цилиндры промывали трижды по 10 мин. солевым раствором Earles и один раз 20 мин. солевым раствором Earles с добавлением 500 МЕ стрептомицина/пенициллина, 4 мкг амфотерицина Β и 10 мкг гентамицина.
Костные цилиндры обрабатывали в соответствии с различными методами стерилизации либо дезинфекции, и применяли для симуляции аллогенной и аутологичной трансплантации кости.
- Симуляция "in vitro" аллогенной и аутологичной трансплантации кости
По 20 дисков губчатой кости от каждого пациента отдельно разместили в 4 лунках шестилуночных планшетов (площадь лунки 9,81 см2 / по 5 цилиндров в лунке). В 4 лунках были размещены губчатые диски с 3x106 клеток (аутологичный: кость и клетки одного и того же пациента) и 3 мл среды IMDM. В пятую лунку засевали 3x106 клеток с 3 мл среды IMDM как контроль. В последнюю лунку добавляли среду IMDM как отрицательный контроль.
- Методы стерилизации и дезинфекции
- Обработка надуксусной кислотой - этанолом. Жировые барьеры, препятствующие проникновению, убирали путём предварительной обработки дисков губчатой кости смесью хлороформа с метанолом. После обезжиривания губчатые диски обрабатывали НУК в течение 4 час. при комнатной температуре. Проникновение стерилизационной среды в обезжиренную губчатую ткань обеспечивалось постоянным движением стерилизационных сосудов.
- Метод Tutoplast® Прежде всего, губчатые диски очищали от водорастворимых веществ и обезжиривали в ультразвуковой ванне. На втором этапе выполняли осмотическую обработку раствором NaCl + H2О (разрушает клеточные мембраны, устраняет антигенность, убивает бактерии, обнажает вирусы). Окислением с добавлением H2О2 инактивировали обнажённые вирусы и устраняли остаточную антигенность. На следующем этапе костные пластины полностью обезвоживали ацетоном. После удаления использованного растворителя костные пластины стерилизовали γ-облучением от 17,8 до 20,1 кГр.
- Гамма-облучение с дозой 25 кГр. Все губчатые диски дважды по 1,5 часа обезжиривали в ацетоне. В заключение, оставшиеся осадки удаляли многократным промыванием в дистиллированной воде. Наконец, костные пластины продували воздухом под давлением 5 бар, чтобы удалить последние фрагменты. Гамма-стерилизацию проводили на фирме Beta-Gamma-Service (BGS) в гор. Виль с дозой 25 кГр.
- Термодезинфекция при 82,5 °C. Перед проведением термодезинфекции заготовленные губчатые диски отмывали в водной ванне от остатков крови и костного мозга. Затем губчатые диски обрабатывали эффективной инактивирующей температурой > 82,5 °C в течение минимум 15 минут.
- Автоклавирование при 121 °C. После очистки и удаления связанных остатков крови и костного мозга в водной ванне, пластины укладывали на компресс, заваривали в двойную плёнку и автоклавировали при 121 °C в течение минут.
- Показатели исследования
Для анализа влияния методов стерилизации и дезинфекции на иммунокомпетентные популяции клеток in vitro в настоящем исследовании рассматривали следующие параметры:
-
Морфологическая оценка в ходе культивирования
- Растровая электронная микроскопия
- Определение жизнеспособности окраской трипановым синим
-
Иммунные реакции
- Анализ FACS
- Растровая электронная микроскопия
Под растровым электронным микроскопом (ISI-SX-30, поставщик Leitz; плёнка Ilfort FP4, поставщик Ilford) через 2 и 4 недели выполняли оценку губчатых дисков и клеток. После фиксации препарата 2% раствором (0,2 Μ какодилатный буфер, изготовитель Serva Heidelberg, Германия / дист. вода / 25% глутаральдегид, изготовитель Merck Darmstadt, Германия), инкубации в 2% растворе тетроксида осмия (изготовитель Degussa Frankfurt, Германия), обезвоживания в возрастающей концентрации ацетона (изготовитель Merck Darmstadt, Германия) и высушивания в камере с критической точкой (Balzer Union, Лихтенштейн), на клетки напыляли золото (500 Å; Sputter Coater (Edwards, West Sussex, СK)).
- Определение жизнеспособности окраской трипановым синим
После 4 недель культивирования клетки переводили во взвешенное состояние, обрабатывая их Accutase®, для определения жизнеспособности. 20 мкл взвеси клеток (минимум 2 × 105 – максимум 4 × 107 клеток/мл) инкубировали с 80 мкл раствора 0,5% трипанового синего. С помощью гемоцитометра было возможно оценивать клетки в отражённом свете под микроскопом (микроскоп Aristomet®, Leitz, ФРГ) с объективом с 10–40-кратным увеличением. Контрольной группой служили клетки костного мозга человека после 4-недельного культивирования. Данные по их оценке считали за 100%. Установленное таким образом число клеток всё же не соответствует реальному числу клеток, поскольку возможна оценка только тех клеток, которые смогли отделиться от связи с матриксом. Сколько клеток осталось окончательно связанными, выяснить невозможно.
- Анализ FACS
Фенотипирование субпопуляций лейкоцитов и степень их созревания оценивали на основании экспрессии определённых молекул на поверхности клетки. При анализе FACS эти поверхностные молекулы выявляются флуоресцентно маркированными антителами. Сумму этих антител, типичных для определённых поверхностных молекул, обозначают как «кластер дифференциации» (Cluster of differentiation – CD).
В день получения клеток, а также после культивирования длительностью 4 недели, выполняли такой анализ FACS.
С помощью Accutase® клетки из лунок либо губчатых дисков, насколько возможно, переводили во взвешенное состояние. Однако технически невыполнима достоверная оценка абсолютного числа клеток на момент анализа FACS, поскольку невозможно точно определить по высвобождению клеток, сколько клеток осталось в губчатых дисках. Клетки инкубировали в течение 2 ч. при комнатной температуре со следующими антителами, иммунокомпетентными против специфических антигенов поверхности:
- TriTest CD3 FITC/CD19 PE/CD45 PerCP; изготовитель Becton Dickinson. CD3-положительные клетки = зрелые T-лимфоциты; CD19-положительные клетки = B-клетки;
- TriTest CD3 FITC/CD4 PE/CD45 PerCP; изготовитель Becton Dickinson. CD3-положительные / CD4-положительные клетки = T-хелперы;
- TriTest CD3 FITC/CD8 PE/CD45 PerCP; изготовитель Becton Dickinson. CD3-положительные / CD8-положительные клетки = супрессорные / цитотоксичные T-клетки;
- TriTest CD3 FITC/CD16 + 56 PE/CD45 PerCP; изготовитель Becton Dickinson. CD3-отрицательные / CD16 + 56 -положительные клетки = природные киллеры (NKZ).
Результаты были представлены в форме системы координат (точечный график), где каждой исследованной клетке соответствует одна точка. Отдельные субпопуляции клеток возможно отделить путём установки ворот и точнее проанализировать. Во избежание неверной интерпретации, при каждом иммунном фенотипировании окрашивали образцы клеток с контрольной смесью антител, которая показывает неспецифическое связывание и применяется для точной установки измерений. Обработку данных выполняли по программе BD Cellquest Pro.
- Статистика
Для статистической оценки данные обрабатывали по методу теста хи-квадрат. При этом величина p < 0,05 считалась статистически значимой. Все величины были представлены как средние с соответствующими стандартными отклонениями.
Результаты
- Растровая электронная микроскопия
Клетки костного мозга человека высевали, как описано выше, на диски губчатой кости. Фиг. 1a–6b показывают снимки под растровым электронным микроскопом с видимой характерной морфологией веретенообразных клеток после 4-недельного культивирования. Во всех случаях обнаруживается проникновение клеток в губчатые структуры, причём аутологичные кости были полностью заселены. На автоклавированных губчатых дисках заметны образование трещин на трабекулах и гладкая, похожая на глазурь, поверхность после выполнения стерилизации, которые не были последствием приготовления. На облучённых губчатых дисках показаны заметное сокращение числа клеток и отсутствие волокнистой сети (фиг. 1a–6b).
- Определение жизнеспособности окраской трипановым синим после 4 недель и высвобождение клеток
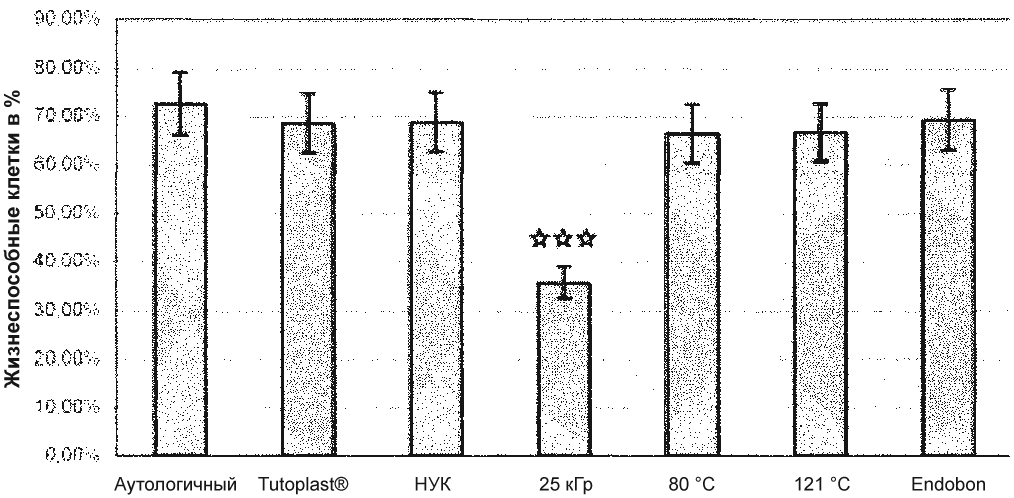
Жизнеспособность клеток после 4-недельного культивирования с дисками губчатой кости представлена на фиг. 7. Значительное сокращение (p < 0,05) показано на облучённых губчатых дисках по сравнению с контрольными культурами, которые приняты за 100% (фиг. 7).
- Анализ FACS
Иллюстрации показывают процентные доли фенотипически определённых субпопуляций всех клеток CD45+ (лимфоцитов). Для обработки использовали по 10 000 случаев в пределах клеточной популяции CD45+.
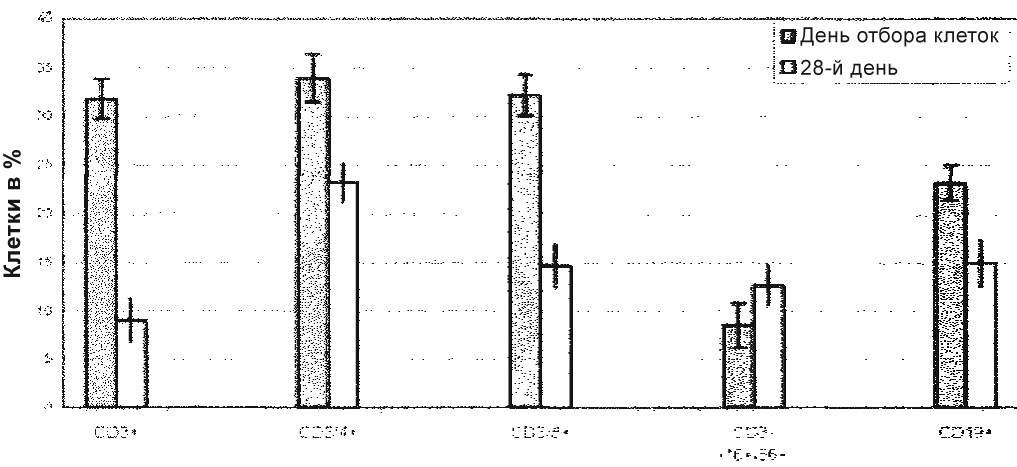
- Контрольные культуры. В контрольных культурах в начале культивирования обнаруживали ~ 31,7% клеток CD3+, доля которых в течение 4 недель снизилась до 9%. Доля клеток CD3/4+ снизилась от ~ 33,9% до ~ 23,2%. Исходно составлявшие долю ~ 32% клетки CD3/8+ также сокращались в количестве до ~ 14,6%. Напротив, доля клеток CD3-/16+/56+ в течение 4 недель возрастала от ~ 8,5% до ~ 12,6%, тогда как доля клеток CD19+ снижалась от ~ 23,1% до ~ 14,9%.
- Аутологичные опыты. По сравнению с контрольными культурами, через 4 недели происходило явное возрастание долей клеток CD3+ (зрелые T‑клетки) до ~ 28% (p < 0,05), клеток CD3/4+ (T-хелперы) до ~ 61% (p < 0,05), клеток CD3/8+ (супрессорные / цитотоксические T‑клетки) до ~ 54% (p < 0,05) и клеток CD3-/16+/56+ (природные киллеры) до ~ 38% (p < 0,05). Доля клеток CD19+ (B-клетки) оставалась почти неизменной при ~ 12%.
- НУК / Этанол. Обработка НУК приводила к сдвигу с повышением доли клеток CD3+ (зрелые T‑клетки) до ~ 21% (p < 0,05) и клеток CD3/4+ (T-хелперы) до ~ 32% (p < 0,05). Напротив, доля клеток CD3/8+ (супрессорные / цитотоксические T‑клетки), а также клеток CD3-/16+/56+ (природные киллеры) оставалась неизменной. В случае клеток CD19+ (B-клетки) было показано одно значительное снижение до 3,8% (p < 0,05).
- Метод Tutoplast®. Обработка Tutoplast® приводила к сдвигу с уменьшением доли клеток CD19+ (B-клетки) до ~ 3,1% (p < 0,05), и с увеличением доли клеток CD3+ (зрелые T‑клетки) до ~ 18,6% (p < 0,05). Другие популяции клеток оставались неизменными.
- Облучение 25 кГр. После облучения 25 кГр происходил явный сдвиг с чрезмерным возрастанием доли клеток CD3/8+ (супрессорные / цитотоксические T‑клетки) до ~ 92% (p < 0,05), клеток CD3/4+ (T-хелперы) до ~ 99% (p < 0,05) и клеток CD3-/16+/56+ (природные киллеры) до ~ 96% (p < 0,05), а также резким падением доли клеток CD3 и CD4+ (зрелые T- и B-клетки) до ~ 3% и ~ 0,1% (p < 0,05).
- Автоклавирование при 121 °C. Стерилизация при 121 °C тоже показала сдвиг состава субпопуляций с возрастанием доли клеток CD3+ (зрелые T‑клетки) до ~ 24% (p < 0,05), клеток CD 3/8+ (супрессорные / цитотоксические T‑клетки) до ~ 21% (p < 0,05) и клеток CD3/4+ (T-хелперы) до ~ 39% (p < 0,05). Доля клеток CD3-/16+/56+ (природные киллеры) оставалась неизменной, тогда как доля клеток CD19+ (B-клетки) снизилась до ~ 8,5% (p < 0,05).
- Термодезинфекция при 82,5 °C. Термодезинфекция при 82,5 °C оставила долю клеток CD3+ (зрелые T-клетки) и клеток CD19+ (B-клетки) неизменной, тогда как доли других субпопуляций, клеток CD3/4+ (T-хелперы) с ~ 45%, клеток CD3/8+ (супрессорные / цитотоксические T‑клетки) с ~ 28% и клеток CD3-/16+/56+ (природные киллеры) с ~ 22% тоже показали значимое повышение (p < 0,05).
 |
 |
Фиг. 1a и b:
a) Исходный образец диска аутологичной губчатой кости;
b) Диск аутологичной губчатой кости через 4 недели культуры.
|
 |
 |
Фиг. 2a и b:
a) Исходный образец диска губчатой кости после обработки НУК;
b) Диск губчатой кости после обработки НУК через 4 недели культуры.
|
 |
 |
Фиг. 3a и b:
a) Исходный образец диска губчатой кости после обработки гамма-облучением;
b) Диск губчатой кости после обработки гамма-облучением через 4 недели культуры.
|
 |
 |
Фиг. 4a и b:
a) Исходный образец диска губчатой кости после обработки методом Tutoplast®;
b) Диск губчатой кости после обработки методом Tutoplast® через 4 недели культуры.
|
- Endobon®
На Endobon® наблюдали сдвиг с уменьшением доли клеток CD19+ (B-клетки) до ~ 4 % (p < 0,05) и возрастанием доли клеток CD3+ (зрелые T-клетки) до ~ 18 % (p < 0,05). Другие популяции клеток оставались неизменными (фиг. 8, 9).
Обсуждение:
Высокая биологическая совместимость была достигнута в применении аутологичных трансплантатов кости – самом естественном методе терапии дефектов кости. Аутологичные трансплантаты кости, хотя и считаются «золотым стандартом», однако часто лимитированы по причине ограниченности ресурсов. Преимущество аллогенных трансплантатов кости, по сравнению с синтетическими материалами, заключается в их способности к остеокондуктивному эффекту (посредством химических или физических факторов, пробуждающих направленный рост остеонов, из которых образуются новые) и частично остеоиндуктивному эффекту (вещество, выделяющееся из материала, приводит к пролиферации и дифференцировке клеток мезенхимы через клетки-предшественники в остеобласты и, наконец, к образованию новой кости) [17].
Эти естественные трансплантаты кости служат как главная система для построения кости и тем самым представляют идеальную архитектуру, отвечающую физиологической морфологии. Важное значение при этом имеет способность частей трансплантата к резорбции, поскольку построению костной ткани остеобластами во всяком случае сопутствует управляемое остеокластами разрушение кости. В связи с этим стимулируется пролиферация клеток мезенхимы и дальнейшая их дифференцировка в остеобласты под действием вновь образующихся веществ, в число которых входят «морфогенетические белки кости» (BMP) [18].
Хотя известно, что различные методы стерилизации изменяют биомеханические свойства трансплантатов кости, в текущей литературе почти не имеется данных о возможном влиянии на биологическую совместимость аллогенных трансплантатов кости после стерилизации разными способами.
 |
 |
Фиг. 5a и b:
a) Исходный образец диска губчатой кости после автоклавирования при 121 °C;
b) Диск губчатой кости после автоклавирования при 121 °C через 4 недели культуры.
|
 |
 |
Фиг. 6a и b:
a) Исходный образец диска губчатой кости после термодезинфекции при 82,5 °C;
b) Диск губчатой кости после термодезинфекции при 82,5 °C через 4 недели культуры.
|
Согласно исследованию Шенка и сотрудников [19] в аспекте биологической совместимости имплантатов кости, было обнаружено выделение веществ в нетоксичных концентрациях, которые могут приводить к инкапсуляции в соединительную ткань или к сильным воспалительным реакциям.
В представленной работе, на основании модели клеточной культуры in vitro, мы решили исследовать влияние стерилизованных либо дезинфицированных различными методами аллогенных костных дисков на дифференцировку костного мозга человека, и сравнить их с опытами на аутологичных дисках.
Методы стерилизации либо дезинфекции
Фиг. 7. Результаты окрашивания трипановым синим через 4 недели (cредние величины и стандартное отклонение для 8 пациентов); *** = p < 0,001.
В действительности, трансплантаты кости, как правило, имплантируют из замороженной кости. Вместе с тем, трансплантаты кости входят в контакт не только с одним типом клеток, но скорее с разнообразными первичными клетками на различных стадиях дифференцировки. Поэтому для анализа in vitro мы решили применить модель культуры клеток костного мозга, чтобы на этой модели наилучшим образом воспроизвести физиологические условия организма человека, и чтобы наблюдаемые реакции было возможно отнести к организму человека.
Как оптимальный трансплантат, в представленной работе рассматривается аутологичный трансплантат кости – «золотой стандарт». Контрольной группой служила культура клеток костного мозга человека.
Специфические антитела
Фиг. 8. Анализ FACS контрольной культуры на момент отбора клеток и через 4 недели культуры; показанные средние величины в % соответствуют процентной доле субпопуляций в общей популяции клеток CD45+ (лимфоциты) с 3-кратным определением для каждого из 8 пациентов. CD3+: зрелые T-клетки; CD3/4+: T-хелперы; CD3/8+: супрессорные / цитотоксические T‑клетки; CD3-/16+/56+: NKZ; CD19+: B-клетки.
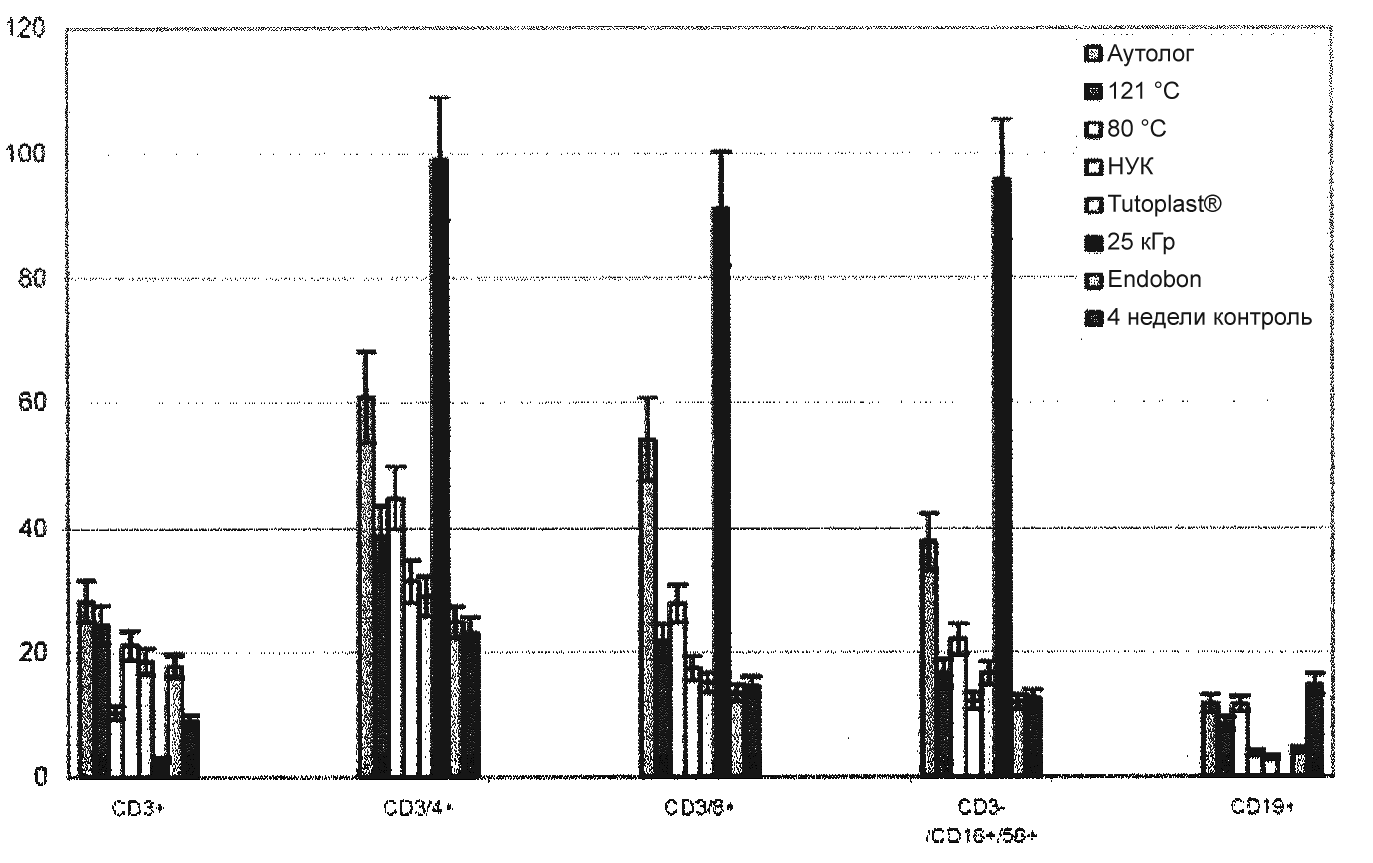 |
Фиг. 9. Анализ FACS после 4 недель культуры; показанные средние величины в % соответствуют процентной доле субпопуляций в общей популяции клеток CD45+ (лимфоциты) с 3-кратным определением для каждого из 8 пациентов. CD3+: зрелые T-клетки; CD3/4+: T-хелперы; CD3/8+: супрессорные / цитотоксические T‑клетки; CD3-/16+/56+: NKZ; CD19+: B-клетки. |
Снимки под растровым электронным микроскопом (фиг. 1a–6b) репрезентативно показывают типичные примеры разных видов колонизации клетками, либо образования матрикса, несмотря на различные увеличения. Несмотря на то, что здесь невозможно получить какие-либо количественные данные, во всех методах подтверждается проникновение клеток в губчатые структуры. Аутологичные кости после 4 недель культуры полностью заселились равномерно распределёнными веретенообразными клетками. Наблюдение в гидроксиапатите костей микротрещин, которые появляются при температурах > 80 °C, а ещё больше – при температурах > 120 °C [20-22], подтверждаются нашими наблюдениями. Дополнительно, в автоклавированных губчатых дисках обнаружена похожая на глазурь поверхность, которая предположительно обусловлена изменением коллагеновых волокон. Эти изменения могут вызывать снижение биологических и биомеханических свойств автоклавированных аллогенных трансплантатов [20-22].
На основании представленного плана экспериментов удалось показать влияние различных методов стерилизации и дезинфекции аллогенных трансплантатов кости на костный мозг.
Технология Tutoplast® и обработка аллогенных трансплантатов НУК / этанолом, так же как Endobon® в сравнении с контрольными культурами не показала явного влияния на CD45-позитивные субпопуляции, хотя по сравнению с тепловыми методами они показывают явное преимущество. Метод Tutoplast® пока ещё не прошёл аттестации на инактивацию избранных клинически важных бактерий, грибов, спор и спорообразователей на аллогенных трансплантатах кости. Применение НУК / этанола для стерилизации головок бедренной кости ограничено по причине большого расстояния диффузии (трансплантаты не должны превышать в толщину 15 мм, чтобы гарантировать достаточную диффузию химикатов в глубину). Применение Endobon® ограничено малыми дефектами кости.
Одно только гамма-облучение на основании результата, полученного в данном исследовании, было отнесено к биологически несовместимым методам. Причина этого, вероятно, заключается в образовании свободных радикалов, которые со своей стороны вызывают повышенную смертность клеток, а значит и снижение биологической совместимости [23].
Отсутствие свидетельства иммунного ответа на трансплантат кости или заменитель кости возможно интерпретировать так, что эти материалы классифицируются как биологически инертные, и тем самым служат лишь как каркас для построения кости [17]. Эта гипотеза подтверждается сведениями о том, что в случае Endobon® поддерживается только остеокондукция, а остеоиндуктивные свойства не проявляются.
По представленным результатам исследования невозможно отдать преимущество ни одному, ни другому из тепловых методов. Шимизу и др. [24] показали, что костные трансплантаты после температурной обработки проявляют различия по реваскуляризации и остеоинтеграции на животных моделях. Костные трансплантаты, которые обрабатывали 5 мин. при 100 °C, показали сниженную реваскуляризацию и остеоинтеграцию. Костные трансплантаты, которые обрабатывали 30 мин. при 60 °C либо 10 мин. при 80 °C, напротив, не показывали ухудшения реваскуляризации и остеоинтеграции. Причина тому, возможно, сохранение коллагена и BMP, которые денатурируют при температурах > 100 °C (повышение температуры приводит к возникновению антигенности и снижению остеокондуктивности). Сопоставление наблюдения микротрещин и похожей на глазурь поверхности под растровым электронным микроскопом на губчатых дисках, автоклавированных при 121 °C, и результатов Шимизу и др., объясняет преимущество метода термодезинфекции при 82,5 °C для аллогенных трансплантатов кости.
В случае аутологичной пересадки кости показан самый заметный иммунный ответ с увеличением зрелых T-клеток, T-хелперов, супрессоров / цитотоксических T-клеток и природных киллеров.
Клетки, которые вступили в контакт с чужеродным материалом, реагируют по защитному механизму. В принципе, этот вид иммунного ответа представляет максимальную реакцию. T-хелперы опосредуют клеточные иммунные реакции и участвуют в дифференцировке B-клеток в плазматические клетки. Зрелые T‑клетки приводят к активации макрофагов, так что начинается реакция, направленная к воспалению. Цитотоксические T‑клетки приводят, как говорит их название, к прямому разрушению клеток, так же как и NKZ. В остеоиммунологической реакции T‑клетки отвечают за образование медиаторов с одновременной активацией остеокластогенеза. В различных исследованиях имеются указания на то, что T‑клетки играют центральную роль в развитии и функциях остеокластов. Где и как цитокины и хемокины, выделяемые in vivo T‑клетками или другими иммунными клетками, влияют на обмен веществ в кости, пока остаётся неясным [25, 26]. Согласно высказанным точкам зрения, активация и пролиферация T-клеток – скорее, нежелательная реакция. Хотя она и происходит при аутологичных пересадках кости для быстрой и полной остеоинтеграции, вместе с тем этот иммунный ответ кажется необходимой предпосылкой и проявлением процесса перестройки кости. К тому же мы можем сослаться на исследование на дефицитных по T-клеткам голых мышах, у которых отсутствие T‑клеток приводило к снижению количества коллагена III, и вместе с тем была нарушена остеокондукция [27].
В целом, представленные результаты показывают, что культура костного мозга человека представляет вполне пригодный метод, чтобы получить предварительные сведения о возможных влияниях методов стерилизации в отношении биологической активности аллогенных трансплантатов кости. Удалось показать при исследованных параметрах in vitro чёткие различия в иммунном ответе при соответствующих использованных методах стерилизации. Для оценки качества стерилизованных трансплантатов кости опыты на животных всё же остаются необходимыми. Следует добавить, что сложные и трудные случаи, в совокупности с физико-химическими взаимодействиями между трансплантатом кости и живой тканью не поддаются или с трудом исследуются in vitro.
Благодарность:
Общественно-полезное объединение Эндоклиника Гамбурга, зарегистрированное общество Германское научное общество EN 710/1-1.
Литература:
- CDC, Center for Disease Control and Prevention. Update: Allograft Associated Bacterial Infections. MMWR 2002; 51: 207–210
- Jerosch J, Castro WH, Granrath M, Rosin H. Knochenbanken in der BRD: Ergebnisse einer Befragung. Unfallchirug 1990; 93: 334–338
- Garrel Τ von. Persönliche Mitteilung auf der Grundlage einer Befragung von 1400 chirurgischen/orthopädischen Kliniken in Deutschland aus dem Jahr 2001.
- Greenwald AS, Boden SD, Goldberg VM, Khan Y, Laurencin CT, Rosier SN. Bone graft substitutes: facts, fictions, and clinical application. JBJS 2001; 83: 98–103
- Knaepler H, Garrel Τ von, Götzen L. Untersuchungen zur Desinfektion und Sterilisation allogener Knochentransplantate. Springer, Berlin, Heidelberg 1994
- Bright RW. Sterilisation of human bone by irradiation. In: Friedländer GE et al. (ed). Osteochondral allografts. Biology, Banking and clinical applications. Little Brown, Boston, Toronto 1987; 223–232
- Versen R von. Heider Η, Kleemann I, Starke R. Chemische Sterilisation biologischer Implantate mit einer Kombinationsmethode. In: Pesch HJ, Stöß H, Kummer Β (Hrsg). Osteologie aktuell. Springer, Berlin 1992; 7 (Suppl): 380–386
- Wutzier P, Sauerbrei A. Virucidal efficacy of a combination of 0.2% peracetic acid and 80% (v/v) ethanol (PAA-ethanol) as a potential hand disinfectant. J Hosp Infect 2000; 46: 304–308
- Hofmann C, Garrel Τ von, Götzen L. Knochenbankmanagement bei Verwendung eines thermischen Desinfektionssystems (Lobator SD-1). Unfallchirurg 1996; 99: 498–508
- Godette GA, Kopta JA, Egle DM. Biomechanical effects of gamma irradiation on fresh frozen allografts in vivo. Orthopedics. 1996; 19: 649–653
- Knaepler H, Haas H, Puschel HU. Biomechanical properties of heat and irradiation treated spongiosa. Unfallchirurgie. 1991; 17: 194–199
- Shin S, Yano H, Fukunaga T, Ikebe S, Shimizu K, Kaku N, Nagatomi H, Masumi S. Biomechanical properties of heat-treated bone grafts. Arch Orthop Trauma Surg. 2005; 125: 1–5
- Vastel L, Meunier A, Siney H, Sedel L, Courpied JP. Effect of different sterilization processing methods on the mechanical properties of human cancellous bone allografts. Biomaterials 2004; 25: 2105–2110
- Endres S, Efe T, Schickl G, Wilke A. Analyse einer humanen Knochenmark-Langzeitzellkultur – Teil I und Teil II. Osteologie 2003; 3: 175–197
- Kalla Ρ, Hintz-Obertreis Ρ, Wilke A, Griss P, Seiler FR, Rüde Ε, Krumwieh D. Bone marrow obtained during hip surgery: a novel source for studies of haemopoiesis in human long-term bone marrow culture (LTBMC). Behring Inst Mitt 1991; 90: 93–98
- Wilke A, Orth J, Lomb M, Fuhrmann R, Kienapfel Η, Griss Ρ, Franke RP. Biocompatibility analysis of different biomaterials in human bone marrow cell cultures. J Biomed Mater Res 1998; 40: 301–306
- Wintermantel Ε, Suk-Woo Η. Medizintechnik mit biokompatiblen Werkstoffen und Verfahren. 3. Überarb. und erw. Aufl.: Springer, Berlin 2002
- Reddi AH. Role of morphogenetic proteins in skeletal tissue engineering and regeneration. Nature Biotechnoln 1998; 16: 247–252
- Schenk RK. Bone response to grafts and implants. In: Lin OCC, Chao EYS (eds). Perspectives on biomaterials. Materials science monographs. Elsevier, Taipei, Taiwan, 1986; 121–136
- Kyoto Universität 1991. Mechanische Festigkeit des erhitzten Knochens. Kyoto Universität 1991
- Kyoto Universität 2001. Die Geschwindigkeit der Knocheneinheilung in Abhängigkeit von der Temperatur des erhitzten Knochentransplantates. Kyoto Universität 2001
- Voggenreiter G, Ascherl R, Blumel G, Schmit Neuerburg KP. Effects of Preservation and Sterilization on Cortical Bone Grafts, A Scanning Electron Microscopic Study. Arch Orthop Trauma Surg 1994; 113: 294–296
- Moreau MF, Gallois Y, Basle MF, Chappard D. Gamma irradiation of human bone allografts alters medullary lipids and releases toxic compounds for osteoblast-like cells. Biomaterials 2000; 21: 369–376
- Shimizu K, Masumi S, Yano H, Fukunaga T, Ikebe S, Shin S. Revascularization and new bone formation in heat-treated bone grafts. Arch Orthop Trauma Surg 1999; 119: 57–61
- Takayanagi H. Inflammatory bone destruction and osteoimmunology. J Periodontal Res 2005; 40: 287–293
- Jaerang R, Masamichi T, Yongwon C. Osteoimmunology: Interactions of the immune and skeletal system. Mol Cells 2004; 1: 1–9
- Endres S, Landgraff M, Kratz Μ, Wilke A. Biocompatibility testing of various biomaterials as dependent on immune status. Ζ Orthop Ihre Grenzgeb 2004; 142: 358–365
