Axel Pruss a*, Michael Seibold b, Frank Benedix a, Lars Frommelt c, Thomas von Garrel d, Lutz Gu ̈rtler e, Yvonne Do ̈rffel f, Georg Pauli g, Ulf Berthold Go ̈bel h
a Institute for Transfusion Medicine (Tissue Bank), University Hospital Charite ́, CCM, Medical Faculty of Humboldt University, Schumannstr. 20/21, Berlin D-10117, Germany
b Robert Koch-Institut, Mycology, Berlin, Germany
с Institute for Infectiology, Clinical Microbiology and Infection Control, ENDO Clinic, Hamburg, Germany
d Clinic for Traumatology, Philipps University, Marburg, Germany
e Loeffler Institute for Medical Microbiology, Ernst Moritz Arndt University, Greifswald, Germany
f Outpatients Clinics, University Hospital Charite ́, Medical Faculty of Humboldt University, Berlin, Germany
g Robert Koch-Institut, Retrovirology, Berlin, Germany
h Institute for Microbiology and Hygiene, University Hospital Charite ́, Medical Faculty of Humboldt University, Berlin, Germany
Received 30 June 2003; accepted 28 August 2003
Марбургская система костного банка "Lobator SD-2" широко используется для получения головок бедренных костей человека термической дезинфекцией в асептического операцинных. Эффективность термодезинфекции с использованием недавно разработанной модели головки бедра была подтверждена в соответствии с действующими стандартами. Исследовались следующие микроорганизмы, бактерии и грибки, взятые из Коллекции Американского банка микроорганизмов (American Type Culture Collection): Staphylococcus aureus, Staphyloccus epidermidis, Enterococcus faecium, Pseudomonas aeruginosa, Bacillus subtilis including spores, Clostridium sporogenes, Mycobacterium terrae, Candida albicans и споры Aspergillus niger. Высоко концентрированная суспензии этих микроорганизмов была внесена в центр бедренных головок. Уменьшение количества микроорганизмов определяли путем подсчета колониеобразующих единиц (КОЕ) до и после обработки в испытательном устройстве Lobator SD-2.
Вегетативные формы бактерий, грибов и споры грибов были полностью инактивованы (понижающий коэффициент ≥6 log 10). Количество спор спор, термостойких, как известно, B. subtilis и C. sporogenes , было уменьшино на один-два порядка. Эти бактерии служат моделями спорообразующих патогенов, которые не опредедяются в бедренных головках от живых доноров. Посредством термической дезинфекции головок бедра человека от живых доноров с использованием Марбургской системы костного банка достигается высокий уровень безопасности по отношению к клинически значимым патогенам. Для дальнейшего повышения безопасности термически обработанных головки бедра, мы рекомендуем принимать во внимание историю болезни и текущее состояние донора, а также данные необходимых серологических тестов.
2003 The International Association for Biologicals. Published by Elsevier Ltd. All rights reserved.
Keywords: Thermodisinfection; Bone transplant; Tissue banking; Lobator; Bone bank; Pathogen transmission
1. Введение - Introduction
В последние годы микробиологическая безопасность пересадок тканей, полученных из человеческих и животных источников привлекала большое внимание [1,2]. Аллогенные трансплантаций кости связывали с передачей вирусов, бактерий и грибов [3-5].
Бактериальная и грибковая контаминация костных трансплантатов может быть следствием инфицированности донора или происходить во время получения. Трансплантаты кости (т.е. головки бедренных костей) могут быть получены либо из живых доноров либо от трупов.
Такие трансплантаты используются, например, в хирургии позвоночника, пересадке искусственного сустава и реконструкции обширных костных дефектов. В США в год трансплантируют 300000-400000 аллогенных костных трансплантатов [6].
Таблица 1. Уровни микробной контаминации ткани при трансплантации аллогенных костей
| Исследования |
Костный трансплантат / уровень контаминации
|
Микроорганизм |
| Husted et al. [8] | 110/1% | S. aureus |
| Barrios et al. [44] | 98/6.6% |
80% Gram-positive bacteria
20% Gram-negative bacteria
|
| Martinez [45] | 21971/8.9% |
734 Staphylococcus spp.
342 Propionibacterium spp.
249 Streptococcus
192 aerobic Gram-negative bacteria
173 Clostridium spp.
|
| Tomford et al. [16] | 303/10% |
90% Propionibacterium acnes and S. epidermidis,
10% non-hemolytic Streptococci and S. aureus (<2%)
|
| Chapman et al. [43] | 35/22.8% |
4 S. epidermidis
1 S. aureus
1 Streptococcus group F
1 H. influenzae
1 Gram-positive Diphtheroids
|
| Fitzgerald et al. [28] | 658/30% |
33% S. epidermidis
22% P. acnes
14% Aspergillus spp.
11% Corynebacterium spp.
9% Streptococcus viridans
|
| Doppelt et al. [42] | 91/37% |
62% S. epidermidis
38% mixed cultures
|
| Deijkers et al. [11] | 1999/53% |
999 microorganisms with low pathogenicity (e.g. Coagulase-negative Staphylococci [CNS],
Corynebacterium spp.)
57 microorganisms with high pathogenicity (e.g. Streptococcus spp. and S. aureus,
P. aeruginosa, Candida spp.)
|
| Veen et al. [9] | 75/92% |
64 CNS
5 Corynebacterium spp.
4 Bacillus spp.
3 S. aureus
|
Хотя разработаны и другие материалы для процедур замещения и реконструкции кости, есть растущий спрос на костные аллогенные трансплантаты [7].
1.1. Уровень контаминации
Трансплантаты загрязненяюся в первую очередь патогенами, передающимися от донора. Они, как правило транспортируется в костную ткань при бактериемии или виремии. Вторичное загрязнение может происходить во время удаления и / или последующей обработки трансплантата или во время имплантации. По опубликованным данным, бактериальное загрязнение аллогенных костных трансплантатов колеблется в широких пределах от 1% [8] до 92% [9]. Этот широкий разброс вызван различием методов, используемых для обнаружения бактерий.
Риск контаминации возрастает при увеличении числа лиц, присутствующих в операционной комнате во время трансплантации [10]. Было показано, что количество колониеобразующих единиц (КОЕ) в операционной комнате, когда в ней находятся пять человек примерно в 37 раз выше по сравнению с пустой операционной. Аналогичное исследование показало, что уровень загрязнения зависит от количества лиц, участвующих в удалении и дальнейшей обработке трансплантата [11].
Кроме того, уровень бактериального загрязнения в операционной может быть снижен путем ограничения количества вовлеченных людей и их физической активности [12]. Беттин и сотрудники считают, что воздух в операционной комнате, персонал, а также хирургические инструменты, выступают в качестве возможных источников бактериального загрязнения [13]. Таким образом, степень загрязнения зависит от ряда различных факторов.
Обзор результатов исследований, касающихся степени загрязнения при аллогенных трансплантациях кости, проведенных в стерильных и / или асептических условиях представлен в таблице 1.
1.2. Уровень инфицирования
При трансплантациях свежезамороженной костной ткани в стерильных условиях сообщают об уровнем инфицирования, начиная с 4% до 17,5% [14,15]. В последующих исседованиях 303 костных трансплантаций сообщено о 21 случаях инфицирования (6,9%), включая некоторые случаи серьезного инфицирования Staphylococcus aureus and S. epidermidis. [16]. После аллогенной трансплантации костной ткани, у 33 из 283 пациентов (11,7%) развилась грамположительная (55%) либо грамотрицательная (18%) бактериальная инфекция, либо инфекция смешанными культурами (27%).
Грамположительный бактериальный спектр состоял из S. epidermidis (67%), S. aureus (22%) и -haemolytic streptococci (11%). Грамотрицательный бактериальный спектр: P roteus spp. и Pseudomonas spp. был также обнаружен у 33%. Кроме того, были обнаружены Escherichia coli и Bacteroides fragilis. Среди смешанных инфекций на энтерококки приходилось 56%, и они также являлись наиболее распространенным видом. Также были обнаружены другие патогены: Enterobacter spp., Pseudomonas spp. and Proteus spp . [17].
Случай заражения Mycobacterium tuberculosis посредством аллогенного костного трансплантата был зафиксирован в 1953 году [18]. В настоящее время,доноры с открытой формой туберкулеза или с туберкулезом в анамнезе исключены из донорства [19]. Достоверный источник сообщаил о смертельной сепсисе от инфекции Clostridium sordellii через 24 ч после реконструктивной операции на колене, хотя трансплантация проходила в асептических условиях. Тем не менее, трансплантат в данном случае не был подвергнут процедуре окончательной стерилизации или дезинфекции [20].
Была зарегистрирована передача болезни Крейтцфельда-Якоба (CJD) при трансплантации твердой мозговой оболочки и роговицы [21-24]. Хотя риск передачи CJD при трансплантации костной ткани в настоящее считается крайне низким [25-28], люди с риском развития нового варианта CJD, исключены из доноров кости.
Это исследование было проведено для проверки эффективности термоинактивации для сокращения количества бактериальных патогенов. В головки бедренных костей (диаметр <56 мм) экспериментально вносили определенные микроорганизмы или спор и обрабатывали их в системе Lobator SD-2. Исследование было проведено в соответствии со следующими стандартами: Европейский стандарт EN 1040 "Химические дезинфектанты и антисептики. - Основная бактерицидная активность», который описывает руководящие принципы для определения бактерицидного эффекта за счет сокращения числа жизнеспособных бактерий по меньшей мере на коэффициент 5 log10 [29] и Европейский стандарт EN 13624 "Количественный суспензионный тест для оценки фунгицидной активности химических дезинфицирующих средств для обработки медицинских инструментов", который рекомендует уменьшение на R5 log 10 [30]. Для исследования процедуры тепловой инактивации была разработана модель, где патогены непосредственно вводились в костную ткань [31].
2. Материалы и методы
2.1. Система ‘Lobator sd-2’
Система термической дезинфекции аллогенных бедренных головок «Lobator SD" был разработана около 10 лет назад [32-36]. Настоящее статья посвящена версии SD-2 (рис. 1).

Fig. 1. Marburg bone bank system (Lobator sd-2).
Головки бедренных костей, полученные в ходе операции замены тазобедренного сустава были помещены в стерильных условиях в жесткий пластмассовый контейнер для дезинфекции после того, как хрящ был удален. Контейнер при комнатной температуре заполнялся до отметки примерно 300 мл стерильного раствора Рингера (Браун, Melsungen, Germany). В нижней части контейнера для дезинфекции содержалась магнитная мешалка, обеспечивающая непрерывную циркуляцию воды, чтобы гарантировать равномерное распределение тепла в процессе дезинфекции. Контейнер герметизировали с помощью плотно прилегающей крышки и переносили в нагревательное устройство.
По техническим соображениям температура измерялась у наружной стенки контейнера. Для бедренных головок с диаметром 56 мм производитель системы дезинфекции гарантирует температуру, по не менее 82,5 С в центре головки бедренной кости в течение минимум 15 мин. Температурный режим (фаза нагрева, плато и фазу охлаждения) в устройстве запрограммирован изготовителем и не может быть изменен пользователем, после завершения процесса дезинфекции печатался отчет со следующими данными: номер устройства и идентификационный номер, дата и время. Запись температуры нагревательного устройства велась в ходе процесса непрерывно каждые 3 мин. Этот отчет служил доказательством процесса дезинфекции и давал информацию о том, был ли завершен процесс как требуется.
2.2. Температура ядра в моделе головки бедра
Недавнее исследование показало, что температура ядра, не менее 82,5 С, поддерживалась в центре головки бедренной кости в течение периода не менее 15 мин, если диаметр головки не превышал 56 мм [31].
2.3. Тест-организмы
Микроорганизмы, используемые в данном исследовании, были выбраны в соответствии с существующими стандартами и рекомендациями, а также по их клиническую значимость. Они включают: S. epidermidis, S. aureus, Enterococcus faecium, Pseudomonas aeruginosa, а также C. sporogenes и Bacillus subtilis и их споры.
Таблица 2. Инкубационные условия и культуральная среда
| Micro-organism | Времы инкубации/температура | Среда |
| S. aureus (ATCC 6538) | 48 h/37 °C | Казеиновый соевый МПА (Merck) |
|
S. epidermidis (ATCC 12228)
|
48 h/37 °C | Казеиновый соевый МПА (Merck) |
| E. faecium (ATCC 6057) | 48 h/37 °C | Casein soy peptone agar (Merck) |
| P. aeruginosa (ATCC 15442) | 48 h/37 °C | Casein soy peptone agar (Merck) |
| B. subtilis (ATCC 6633) | 48 h/37 °C | Casein soy peptone agar (Merck) |
| B. subtilis spores (ATCC 6633) | 48–72 h/37 °C | Casein soy peptone agar (Merck) |
| C. sporogenes (ATCC 19404) | 48 h/37 °C | Casein soy peptone agar (Merck) |
| M. terrae (ATCC 15755) | 3–4 weeks/37 °C | Милдбрук 7H10 Агар+OADC (Becton Dickinson) |
| C. albicans (10231) | 48 h/37 °C | Солодовый агар (Merck) |
| A. niger spores (ATCC 16404) | 48–72 h/30 °C | Солодовый агар(Merck) |
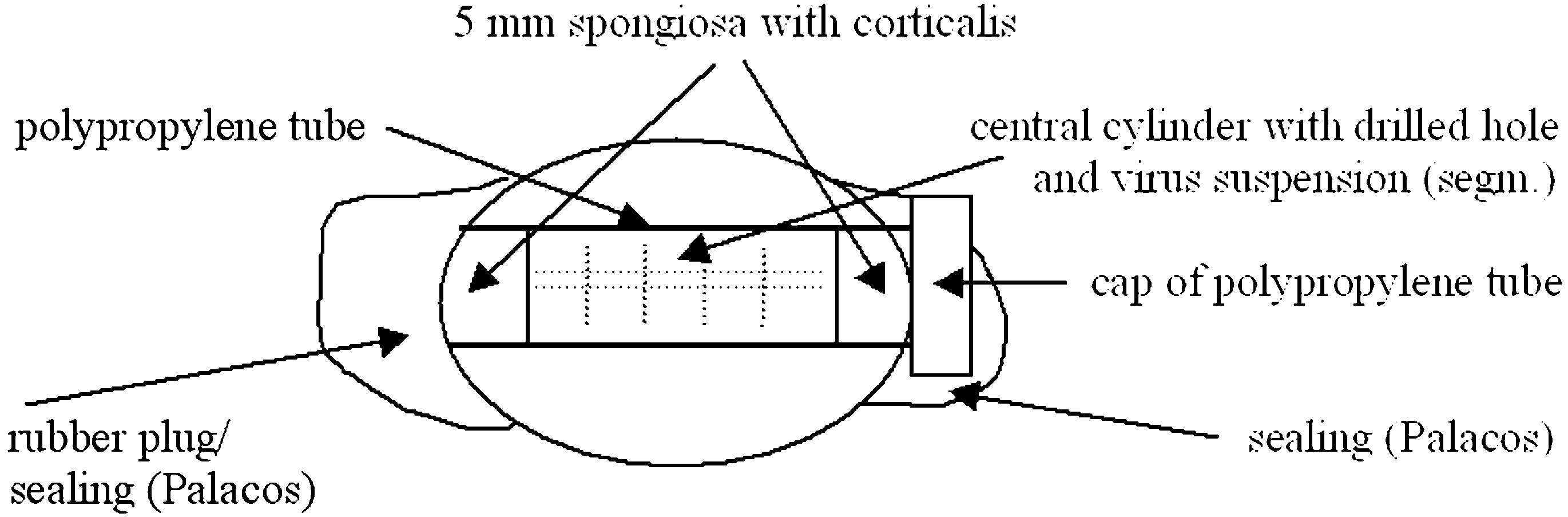
Fig. 2. Схема получения модели головки бедра.
M. terrae использовалась как модель M. tuberculosis. Дополнительно были тестированы C. albicans и споры Aspergillus niger.
В Таблице 2 представлены тестовые организмы (банк Robert Koch-Institut, Berlin) и условия их культивирования
Для бактерий, грибов и их спор были подготовлены суспентии с титрами в диапазоне от from 1х10 8 до 5х10 8 КОЕ/мл путем определения оптической плотности каждой суспензии в ELISA ридере (Dynatech MR 5000, Guernsey Channel Island, UK), и путем двух независимых определений были определены КОЕ/мл. Споры A. niger and B. subtilis были подсчитаны в модифицированной счетной камере, затем был рассчитан титр.
2.4. Процесс изготовления модельной головки
В качестве модели (см 2.) были использованы головки бедренных костей человека с минимальным диаметром 55 1 м м после удаления хряща и мягких тканей [31]. Головки бедренных костей были получены в ходе первичной операции по замене тазобедренного сустава. Все доноры отвечали требованиям действующих национальных руководящих принципов для костных банков [19].
Костный цилиндр диаметром 15 мм был выпилен из головки бедренной кости при постоянном охлаждении с помощью лобзика. Полученный сквозной канал головки бедренной кости был расширен до 17 мм, чтобы вместить полипропиленовую пробирку 17 мм в диаметре с винтовой крышкой (BD FalconTM Conical Centrifuge Tubes, BD Biosciences Discovery Labware, Heidelberg).
Фальконовская пробирка 120 мм была обрезана с нижнего конца до длины цилиндра в головке бедренной кости. Нижний конец полипропиленовой пробирки был плотно закрыт резиновой пробкой. В нижней части трубы фиксировали резиновую пробку при помощи костного цемента Palacos R (Heraeus Kulzer, Wehrheim, Germany).
Из одного конца костного цилиндра был вырезан 5 мм диск, чтобы служить в качестве крышки. Затем в костном цилиндре было пробурено центральное отверстие диаметром 6 мм и длиной приблизительно 45 мм. Отверстие было просверлено в нижней части костного цилиндра, соблюдая расстояние от дна в 5 мм. Таким образом, был гарантирован непосредственный контакт тестовой суспензии с окружающей костной тканью. Далее цилиндр распилили на сегменты толщиной около 5 мм, чтобы обеспечить дальнейшую обработку костного цилиндра в Omni-смесителе (тип ОМ, И. Sorvall Inc., Norwalk, USA). Нижний сегмент и напиленные из цилиндра диски были затем помещены в пробирку, и закрыты костной крышкой. Наконец полипропиленовую трубку закрыли винтовой крышкой.
2.5. Контаминирование, термодезинфекция, титрование
Костная крышка была удалена из полипропиленовой пробирки, и приблизительно 1 мл соответствующей суспензии при помощи пипетки был внесен в высверленное отверстии при комнатной температуре (20-25 °C). Крышка была возвращена на место, далее пробирка была плотно закрыта винтовой крышкой.
Для каждого эксперимента (два различных эксперимента в разное временя для каждого микроорганизма) были исследованы две модели.
После завершения процесса дезинфекции - определялось по завершению программы Lobator - суспензию собирали из центрального цилиндра (в обработанном и необработанном образце), чтобы определить КОЕ. Затем крышка кости, сегменты
цилиндра, и нижний диск были удалены, помещены в стерильную емкость из нержавеющей стали Omni-миксера (Sorvall) и гомогенизированы в ледяной бане в
9 мл стерильной NaCl (0,9%) (Braun, Melsungen/Germany). Осадок костного гомогената оставался на дне сосуда, а надосадочную жидкость удаляли. Из
оставшегося губчатого костного гомогената (около 1 г), патогены элюировали 4-мя мл стерильной NaCl (0,9%) в течение 3 мин на Vortex Genie (WINN B.V., Tolbert,
Netherlands). Микробные титры в обоих растворах были определены при условиях культивирования, приведенных в таблице 2.
Концентрацию спор B. subtilis определяли методом глубинного посева (1 мл суспензии спор и 19 мл агаровой среды, содержащей фактор роста). Титры
были определены с учетом разведения. Точность обнаружения обоих методов составила %10 КОЕ/мл. Снижение титра определялось как разница между количеством КОЕ необработанного образца и образца, обработанного в Lobator SD-2.
3. Результаты
Результаты (таблица 3) для супернатантов показывают, что обработка головки бедра в системе Lobator SD-2 привела к снижению титра ≥ 6 log10 в центре головки бедра человека для всех испытанных патогенов, кроме спор B. subtilis и C. sporogenes. Для спор B. subtilis (0,77 и 1,36 log10 ) и С. sporogenes (1,85 и 1,73 log10) не наблюдалось значительное снижение. В гомогенатах (супернатант из гомогената костного цилинра) снижение титра не менее 5 log10 была достигнута для всех испытанных патогенных микроорганизмов, за исключением спор B. subtilis (0,60 и 1,24 log10) и C. sporogenes (1,58 и 1.78 log10). Из-за низкой начальной титра в A.niger в эксперименте I, был обнаружено снижение титра только на 4,43 log10 в гомогенате. Для губчатой кости (элюирования от остальной кости в гомогенате) было определено снижение на не менее 4 log10 , кроме A. niger (из-за технологических процессов), спор B. subtilis и C. sporogenes. В эксперименте I, за исключением A. niger, снижения составило лишь ≥3.15 log10. Снижение для спор B. subtilis (0,33 и 1,15 log10) и С. sporogenes (1,34 и 1,77 log10) было низким.
В таблице 3 также приведены начальные титры и результаты положительного контроля (инкубации загрязненной головки бедренной кости при комнатной температуре). Темпы восстановления положительных контролей соответствуют соответствующим титрам испытательной суспензии.
4. Обсуждение
За последние десять лет с целью уменьшить или полностью исключить риск передачи инфекции от аллогенных трансплантатов кости были опубликованы многочисленные национальные и международные рекомендации и руководящие принципы [19,37-40].
Термолабильность наиболее клинически значимых микроорганизмов и недостатки альтернативных процедур инактивации, такие как потеря механических свойств костных трансплантатов, привело к разработке Марбургской системы костного банка [33], в настоящее время известной как как Lobator SD-2. Эта система была исследована с использованием тестовой модели, которая была специально разработана, чтобы продемонстрировать эффективность тепловой дезинфекции головки бедра. В этом исследовании было изучены разнообразные клинически значимые бактерий, грибы и их споры в соответствии с требованиями DIN EN стандартов и требованиям GLP.
Нагрев до ≥82.5 С, поддержание температуры 82,5 С в течение не менее 15 мин и охлаждения от 82,5 до ниже 60 С привело к полной инактивации вегетативных форм бактерий и грибов, в том числе спор A.niger.
Как и ожидалось, количество бактериальных спор уменьшалось незначительно при воздействии умеренного влажного нагрева, как в тестируемой системы. Тем не менее, эти споры, как правило, не присутствовали в костной ткани, полученной в
стерильных условиях. Загрязнение происходит только тогда, когда пренебрегают основными принципами асептической хирургии. Полученные результаты соответствуют выводам Knaepler и коллег, показавшим полную инактивации (≥6 log10) вегетативных форм S. aureus, E. coli, Proteus vulgaris и P. aeruginosa с использованием влажного нагрева 80 С в течение 10 мин [32].
Для спор A.niger, точное определение начального титра оказалось проблематичным. Темпы восстановления были ниже, чем у других тест-организмов. Это может быть результатом адгезии гидрофобной конидии (споры) как к поверхности пластика, так и к стенке контейнера, наконечникам пипеток или стеклянным предметам, таким как шпатель Дригальского. Другим возможным объяснением является то, что агрегация конидий в водной среде может влиять на метод подсчета КОЕ. Хотя на основании
практического опыта потерей жизнеспособности можно пренебречь. В то же время при изучении процесса стерилизации с использованием смеси надуксусной кислоты и этанола Прусс и сотрудники выявили для A. niger более низкие темпы восстановления, чем ожидалось [41].
Высокая термстойкость бактериальных спор не может быть преодолена обработкой в Lobator SD-2.
Таблица 3. Инактивация бактерий и спор в системой ‘Lobator sd-2’
| Микроорганизм | Начальный титр (КОЕ/мл) | Позитивный контроль 94 min-(КОЕ/мл) | ‘Lobator sd-2’ 94 min-(КОЕ/мл) | Снижение титра (log10) | ||||
| experiment I | experiment II | experiment I | experiment II | experiment I | experiment II | experiment I | experiment II | |
| S. aureus supernatant homogenate* bone** | 1.6x108 | 1.0x108 |
3.2x108
1.0x107
1.8X106
|
5.4x107
3.0x106
3.4x105
|
≤10
≤10
≤10
|
≤10
≤10
≤10
|
≥7.51
≥6.00
≥5.26
|
≥6.73
≥5.48
≥4.53
|
| S. epidermidis supernatant homogenate* bone** | 7.5x107 | 1.3x108 |
2.1x108
9.6x106
1.4x106
|
9.6x107
1.4x107
2.1x106
|
≤10
≤10
≤10
|
≤10
≤10
≤10
|
≥7.32
≥5.98
≥5.15
|
≥6.98
≥6.15
≥5.32
|
| E. faeciun supernatant homogenate* bone** | 5.0x108 | 4.8x108 |
7.3x108
2.0x107
2.5x106
|
4.3x108
3.8x107
2.8x106
|
≤10
≤10
≤10
|
≤10
≤10
≤10
|
≥7.86
≥6.30
≥5.40
|
≥7.63
≥6.58
≥5.45
|
| P. aeruginosa supernatant homogenate* bone** | 2.8x108 | 2.7x108 |
1.4x108
2.2x107
1.7x106
|
1.1x108
5.5x106
1.3X106
|
≤10
≤10
≤10
|
≤10
≤10
≤10
|
≥7.15
≥6.34
≥5.23
|
≥7.04
≥5.74
≥5.11
|
| M. terrae supernatant homogenate* bone** | 1.1x108 | 5.7x107 |
1.0x108
4.9x106
6.5x105
|
5.3x107
4.6x106
3.7x105
|
≤10
≤10
≤10
|
≤10
≤10
≤10
|
≥7.00
≥5.69
≥4.81
|
≥6.72
≥5.66
≥4.57
|
| C. sporogens supernatant homogenate* bone** | 3.6x107 | 4.3x107 |
3.5x107
2.0x106
1.7x105
|
2.0x107
1.8x106
1.5x105
|
4.9x105
5.2x104
7.7x103
|
3.7x105
3.0x104
2.6x103
|
1.85
1.58
1.34
|
1.73
1.78
1.77
|
| B. subtilis supernatant homogenate* bone** | 1.8x108 | 5.0x108 |
4.3x107
1.0x107
9.4x105
|
4.8x108
1.0x107
1.0x106
|
≤10
≤10
≤10
|
≤10
≤10
≤10
|
≥6.73
≥6.00
≥4.97
|
≥7.68
≥6.00
≥5.00
|
| B. subtilis spores supernatant homogenate* bone** | 5.5x107 | 3.8x107 |
1.5x107
9.1x105
1.4x105
|
6.5x107
6.0x106
8.5X105
|
2.6x106
2.3x105
6.6x104
|
2.8x106
3.5x105
6.0X104
|
0.77
0.60
0.33
|
1.36
1.24
1.15
|
| C. albicans supernatant homogenate* bone** | 1.9x108 | 2.2x108 |
2.2x108
9.0x106
8.8x105
|
1.4x108
5.9x106
6.6x105
|
≤10
≤10
≤10
|
≤10
≤10
≤10
|
≥7.34
≥5.95
≥4.94
|
≥7.15
≥5.77
≥4.82
|
| A. niger supernatant homogenate* bone** | 2.8x107 | 5.3x107 |
1.7x107
2.7x105
1.4x104
|
6.6x107
1.1x106
1.5x105
|
≤10
≤10
≤10
|
≤10
≤10
≤10
|
≥6.23
≥4.43
≥3.15
|
≥6.82
≥5.04
≥4.18
|
Супернатант из высверленного отверстии. Гомогенат -супернатант из цилиндра (1 часть кости, 9 частей буфера).
Костный элюат из гомогената губчатого вещества кости (1 часть кости, 4 части буфера).
* Разведенный гомогенат(1:10).
** Осадок гомогената губчатой кости, разведение (1:5).
Как и ожидалось, для спор В. subtilis наблюдалось только небольшое снижение титров на 0,74 и 1,07 log 10 . Можно предположить, что это связано с тем, что обработка в течении 94 мин индуцирует прорастание спор. Из-за питательных веществ, доступных при непосредственном контакте кости и благоприятной температуре во время фаз нагревания и охлаждения, часть спор могла перейти в вегетативную форму. Проросшие споры и вегетативные формы B. subtilis, возможно, были разрушены, таким образом имитировалось количественное сокращение спор. С другой стороны, агрегация спор B. subtilis могла также имитировать снижение.
Кроме того, для С. sporogenes наблюдалось лишь незначительное снижение титра начиная с 1,56 - 1,79 log10. Объяснением такого низкого коэффициента инактивации является быстрое образование спор, которое уже можно было наблюдать в посеве. Тем не менее, мы предполагаем, что вегетативные формы С. sporogenes инактивируются, а споры выживают. Использование другого тест-организма (например, Clostridium spp.) с более низким спорообразованием может дать дополнительную информацию о фактической эффективности процедуры инактивации clostridiae.
Риск передачи спор через головку бедра может быть практически полностью исключен, так как костные трансплантаты от живых доноров изымаются исключительно в стерильных условиях. В этих условиях присутствуют только вегетативые, неспорообразующие бактерии, способные вызвать вторичную контаминацию [35]. Если спорообразующие бактерии присутствуют, микробиологические испытания жидкости, полученной при термической дезинфекции спобобны выявить эти уцелевшие микроорганизмы. Головки бедренных костей, которые показывают рост бактерий в жидкости, не применимы в качестве костных трансплантатов и должны быть уничтожены.
Эффективность "Lobator SD-2" при инактивации вирусов уже была показана в предыдущих исследованиях [31]. Результаты, опубликованные здесь, демонстрируют крайне низкий риск передачи бактериальных и грибковых инфекций для аллогенных трансплантатов кости, обработанных при помощи Марбургской ситемы костного банка Lobator SD-2.
Таким образом, показана безопасность и эффективность применения "Марбургской системы костного банка" для получения аллогенных бедренных головок от живых доноров.
Благодарность
Авторы благодарят Mrs Antweiler, Mr Schurig и Mr Schweiger за большую техническую поддержку.
Ссылки
[1] Kakaiya R, Miller WV, Gudino MD. Tissue transplant transmitted infections. Transfusion 1991;31(3):277–84.
[2] Wilmes E, Gu ̈rtler L, Wolow H. Zur U Infektionen durch allogene Transplantate. Laryngo Rhino Otol 1987;66:332–4.
[3] CDC. Transmission of HIV through bone transplantation: case report and public health recommendations. MMWR 1988; 37:597–9.
[4] Habal MB, Reddi AH. Bone grafts and bone substitutes. Philadelphia/London/Toronto: Saunders, 1992.
[5] CDC. Hepatitis C virus transmission from an antibody-negative organ and tissue donor. MMWR 2003;52:273–6.
[6] von Garrel T, Gotzen L. Allogene Knochentransplantation und Knochenbanking. Unfallchirurg 1998;101:713–27.
[7] Jerosch J, Castro WHM, Granrath M, Rosin H. Knochenbanken in der BRD. Unfallchirurg 1990;93:334–8.
[8] Husted H, Kramhoft MU. Microbiology of femoral head grafts in bone banks. Ugeskr Laeger 1996;158(44):6260–2.
[9] Veen MR, Bloem RM, Petit PL. Sensitivity and negative predictive value of swab cultures in musculoskeletal allograft procurement. Clin Orthop 1994;300:259–63.
[10] Ritter MA, French ML, Hart JB. Microbiological studies in a horizontal wall-less laminar air-flow operating room during actual surgery. Clin Orthop 1973;97:16–8.
[11] Deijkers RL, Bloem RM, Petit PL, Brand R, Vehmeyer SB, Veen MR. Contamination of bone allografts: analysis of incidence and predisposing factors. J Bone Joint Surg Br 1997;79(1):161–6.
[12] Fitzgerald RH Jr, Washington JA 2nd. Contamination of the operative wound. Orthop Clin North Am 1975;6(4):1105–14.
[13] Bettin D, Buchholz B, Dietl KH, Harms C. The analysis of bacterial results in the kidney perfusion fluid and bone allografts in human multiorgan donors. Cell and Tissue Banking 2000; 1:313–6.
[14] Regel G, Su ̈dkamp NP, Illgner A, Buchenau A, Tscherne H. 15 Jahre allogene Knochentransplantation. [15 years allogeneic bone transplantation. Indications, treatment and results]. Unfallchirurg 1992;95(1):1–8.
[15] Su ̈dkamp NP, Haas NP, Tempka A, Veuskens A, Kirchhoff A, Tscherne H. Indikation und Ha ̈ufigkeit von Spongiosatransplantationen bei offenen Frakturen: Analyse von 470 offenen Frakturen. [Indications and incidence of cancellous bone transplantation in open fractures: analysis of 470 open fractures]. Akt Traumatologie 1993;23(4):169–77.
[16] Tomford WW, Starkweather RJ, Goldman MH. A study of the clinical incidence of infection in the use of banked allograft bone. J Bone Joint Surg Am 1981;63(2):244–8.
[17] Lord CF, Gebhardt MC, Tomford WW, Mankin HJ. Infection in bone allografts. Incidence, nature, and treatment. J Bone Joint Surg Am 1988;70(3):369–76.
[18] James JIP. Tuberculosis transmitted by bone bank. J Bone Joint Surg Br 1953;35:578.
[19] Wissenschaftlicher Beirat der Bundesa ̈rztekammer. Richt-rzteblatt
linien zum Fu ̈hren einer Knochenbank. Deutsches A 2001;98(15):A1011–1016.
[20] CDC. Update: Allograft-associated bacterial infections—United States 2002. MMWR 2002;51(10):207–10.
[21] CDC. Creutzfeldt–Jakob disease in a patient receiving a cadeveric dura mater graft. MMWR 1987;36(21):324–5.
[22] CDC. Creutzfeldt–Jakob disease in a second patient who received a cadeveric dura mater graft. MMWR 1989;38(3):37–8.
[23] Duffy P, Wolf J, Collins G, De Voe AG, Streeten B, Cowen D. Possible person-to-person transmission of Creutzfeldt–Jakob disease. N Engl J Med 1974;290:692–3.
[24] Thadani V, Penar PL, Partington J, Kalb R, Janssen R, Schonberger LB et al. Creutzfeldt–Jakob disease probably acquired from a cadaveric dura mater graft. Case report. J Neurosurg 1988;69(5):766–9.
[25] EMEA/410/01/rev 1. Note for guidance on minimizing the risk of transmitting animal spongiform encephalopathy agents via human and veterinary medicinal products. Committee for proprietary medicinal products (CPMP) 2001, London.
[26] Frommelt L. Mikrobiologische Aspekte der allogenen Knochentransplantation. 63. Jahrestagung, Deutsche Gesellschaft fur Unfallchirurgie e.V.; November 17–20, 1999, Berlin.
[27] Sogal A, Tofe AJ. Risk assessment of bovine spongioform encephalopathy transmission through bone graft material derived from bovine bone used for dental applications. J Periodontol 1999;70(9):1053–63.
[28] Fitzgerald RH Jr, Peterson LF, Washington JA 2nd, Van Scoy RE, Coventry MB. Bacterial colonization of wounds and sepsis in total hip arthroplasty. J Bone Joint Surg Am 1973;55(6):1242–50.
[29] Europa ̈ische Norm EN 1040. Chemische Desinfektionsmittel und Antiseptika, Bakterizide Wirkung (Basistest). Pru ̈fverfahren und Anforderungen. [Chemical disinfectants and antiseptics—Basic bactericidal activity] CEN (Europa ̈isches Kommitee fur Normung) 1997, Brussel.
[30] prEN 13624. Quantitativer Suspensionsversuch zur Pru ̈fung der fungiziden Wirkung chemischer Desinfektionsmittel fu ̈r Instrumente im humanmedizinischen Bereich. [Quantitative suspension test for evaluation of fungicidal activity of chemical disinfectants for instruments used in the medical area]. Deutsches Institut fu ̈r Normung (DIN), 1999.
[31] Pruss A, Kao M, von Garrel T, Frommelt L, Gu ̈rtler L, Benedix F et al. Virus inactivation in bone tissue transplants (femoral heads) by moist heat with the ‘Marburg Bone Bank System’. Biologicals 2002;31:75–82.
[32] Knaepler H. Thermische Spongiosa—Desinfektion. MedReport 1995;33:2–3.
[33] Knaepler H, von Garrel T, Gotzen L. Untersuchungen zur Desinfektion und Sterilisation allogener Knochentransplantate. Unfallchirurg (Hefte) 1994;235:1–101.
[34]Knaepler H, von Garrel T, Seipp HM, Ascherl R. Experimentelle und klinische Untersuchungen zur thermischen Desinfektion allogener Knochentransplantate und deren Einbauverhalten. Orthop Praxis 1992;1:23–7.
[35]Knaepler H, von Garrel T, Seipp HM, Ascherl R. Experimentelle Untersuchungen zur thermischen Desinfektion und Sterilisation allogener Knochentransplantate und deren Auswirkungen auf die biologische Wertigkeit. [Experimental studies of thermal disinfection and sterilization of allogeneic bone transplants and their effects on biological viability]. Unfallchirurg 1992;95(10):477–84.
[36] von Garrel T, Knaepler H, Gu ̈rtler L. Untersuchungen zur Inaktivierung von HIV-1 in humanen Femurko ̈pfen durch Ver- wendung eines thermischen Desinfektionssystems Lobator SD-1. [Inactivation of HIV-1 in human femur heads using a heat disinfection system (Lobator SD-1)]. Unfallchirurg 1997;100(5):375–81.
[37] Bekanntmachung des Paul-Ehrlich-Institutes und des Bundesinstitutes fu ̈r Arzneimittel und Medizinprodukte. Anforderungen an Validierungsstudien zum Nachweis der Virussicherheit von Arzneimitteln aus menschlichem Blut oder Plasma. Bundesanzeiger 1994;84:4742–4.
[38] Bundesinstitut fu ̈r Arzneimittel und Medizinprodukte. Bekanntmachung zu allogenen Gewebetransplantaten. Bundesanzeiger 1996;75:4670.
[39] CPMP. Note for guidance on virus validation studies: The design, contribution and interpretation of studies validating the inactivation and removal of viruses. Final version BWP/268/95, London, February 1996.
[40] CEN. Sterilization of medical devices utilizing tissues-validation of the inactivation of viruses and other transmissible agents. Final version 316/WG3/N-02, Bru ̈ssel, 1994.
[41] Pruss A, Baumann B, Seibold M, Kao M, Tintelnot K, von Versen R et al. Validation of the sterilization procedure of allogeneic avital bone transplants using peracetic acid-ethanol. Biologicals 2001;29:59–66.
[42] Doppelt SH, Tomford WW, Lucas AD, Mankin HJ. Operational and financial aspects of a hospital bone bank. J Bone Joint Surg Am 1981;63(9):1472–81.
[43] Chapman PG, Villar RN. The bacteriology of bone allografts. J Bone Joint Surg Br 1992;74(3):398–9.
[44] Barrios RH, Leyes M, Amillo S, Oteiza C. Bacterial contamination of allografts. Acta Orthop Belg 1994;60(2):152–4.
[45] Martinez O. Microbiologic screening of cadaver donors and tissues for transplantation. 26th Annual Meeting, American Association of Tissue Banks. Boston, Massachusetts, August 2002.
